Скандий
СКАНДИЙ (Scandium) Sc, хим. элемент III гр. периодич. системы, ат. н. 21, ат. м. 44,9559; относится к редкоземельным элементам. Известен один прир. стабильный изотоп 45Sc. Поперечное сечение захвата тепловых нейтронов 1,66·10-21 м2. Конфигурация внеш. электронных оболочек атома 3d14s2; устойчивая степень окисления + 3, редко + 1, + 2; энергии ионизации при последоват. переходе от Sc0 к Sc3+ равны соотв. 6,5616, 12,80 и 24,76 эВ; сродство к электрону — 0,73 эВ; электроотрицательность по Полингу 1,3; атомный радиус 0,164 нм, ионный радиус Sc3+ 0,089 нм (координац. число 6), 0,101 нм (8).
Скандий-рассеянный литофильный элемент, геохимически близок РЗЭ иттриевой группы, Mg, Аl, Мh, Zr и Ti. Среднее содержание скандия в земной коре 1 · 10-3 % по массе, концентрация скандия в речных водах 4·10-8 г/л. подземных (2,2-5) x x 10-8 г/л, в воде океанов -8·10-10 г/л. Известно более 120 минералов-носителей скандия. Собств. минералы скандия (очень редки): тортвейтит (Sc,Y)2Si2O7, баццит Sc2Be3Si6Ol8, джервисит NaScSi2О6, каскандит CaScSi3O8(ОН), кольбекит (эггонит) ScPO4 · 2Н2 О.
Свойства. Скандий-легкий серебристый металл с характерным желтым отливом, существует в двух кристаллич. модификациях: до 1336°С устойчива a-форма с гексагон. решеткой типа Mg, а = 0,33085 нм, с = 0;52680 нм, z=2, пространств группа Р63/ттс, рентгеновская плота. 2,989 г/см3; выше 1336°С существует b-форма с кубич. объемноцентрир. решеткой; DH перехода 4,01 кДж/моль; т. пл. 1541 °С, т. кип. 2837 °С; давление пара 10,24 Па (1541 °C;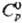 25,51 Дж/(моль·К);
25,51 Дж/(моль·К); 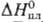 14,1 кДж/моль,
14,1 кДж/моль, 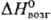 377,7 кДж/моль,
377,7 кДж/моль, 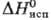 : 314,2 кДж/моль;
: 314,2 кДж/моль;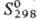 34,77 Дж/(моль·К); температурный коэф. линейного расширения 1,18·10-5 К-1; r 5,141 x 10-7 ОМ·М· слабый парамагнетик, магн. восприимчивость +2,4·10-5 (290,4 К). Скандий-меткий металл, с чистотой 99,5% Sc и выше (в отсутствие О2) легко поддается мех. обработке: твердость по Бринеллю 390 МПа; модуль упругости 56,7 ГПа; модуль сдвига 29,4 ГПа; коэф. Пуассона 0,279.
34,77 Дж/(моль·К); температурный коэф. линейного расширения 1,18·10-5 К-1; r 5,141 x 10-7 ОМ·М· слабый парамагнетик, магн. восприимчивость +2,4·10-5 (290,4 К). Скандий-меткий металл, с чистотой 99,5% Sc и выше (в отсутствие О2) легко поддается мех. обработке: твердость по Бринеллю 390 МПа; модуль упругости 56,7 ГПа; модуль сдвига 29,4 ГПа; коэф. Пуассона 0,279.
По хим. св-вам скандий имеет как сходство с элементами III гр. (Al, Ga, In, РЗЭ), так и существ. различия. Скандий химически высокоактивен. На воздухе покрывается защитной пленкой Sc2O3 толщиной до 15-60 нм, заметное окисление на воздухе начинается при 250 °С, в атмосфере О2-при 200 °C С Н2 реагирует выше 450 °С с образованием гидрида ScHx, где x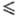 2, с N2-при 600-800 °С, давая нитрид ScN, с галогенами-при 400-600 °С с образованием ScHal3. Металлический скандий легко взаимод. с р-рами НС1, H2SO4, HNO3. Разб. р-ры NaOH (10% по массе) и смесь конц. HNO3 и HF (1:1) практически не взаимод. с Sc. Скандий реагирует с металлами (кроме Сг, V, Hf, Та), образуя интерметаллиды или твердые р-ры.
2, с N2-при 600-800 °С, давая нитрид ScN, с галогенами-при 400-600 °С с образованием ScHal3. Металлический скандий легко взаимод. с р-рами НС1, H2SO4, HNO3. Разб. р-ры NaOH (10% по массе) и смесь конц. HNO3 и HF (1:1) практически не взаимод. с Sc. Скандий реагирует с металлами (кроме Сг, V, Hf, Та), образуя интерметаллиды или твердые р-ры.
Оксид (сесквиоксид) Sc2O3 при обычном давлении существует в кубич. модификации (С-тип, см. табл.) или аморфном состоянии; при 1000°С и давлении 13 ГПа образуется моноклинная модификация (а = 1,3173 нм, b = 0,3194 нм, с = 0,7976 нм, b =100,67°, z = 6, плотн. 4,16 г/см3); устойчив к гидролизу, взаимод. с р-рами минер. к-т, с р-рами щелочей не реагирует; получают разложением гидрокси-да, нитрата, оксалата и др. соединений скандия при 400-500 °С (аморфный) или 800-1000 °С (кристаллич. Sc2O3). Образует скандиаты (MIScO2, MIISc2O4), смешанные оксиды (напр., 2Sc2O3-3ZrO2).
Гидроксиды скандия бесцветны, по составу и строению аналогичны гидроксидам Al, Fe и Ga; из р-ров солей скандия осаждается NH3 и щелочами при рН 3,9-8,5 аморфный Sc (ОН)3 · n H2 О с высокой степенью гидратации, на воздухе постепенно обезвоживается до Sc2О (ОН)4 и Sc2 О2 (ОН)2 x x 2H2О; подвержен старению с образованием мелких кристаллов. Кристаллич. Sc(OH)3 получен в гидротермальных условиях; решетка кубич. (а = 0,7888 нм, z = 8; плотн. 2,68 г/см3). Известен кристаллич. ScO(OH); при атм. давлении при 370 °С получена a-модификация с ромбич. решеткой типа a-АlO(ОН); не раств. в воде (7·10-5 г/л Sc2O3 при 25 °С), незначительно раств. в р-рах NH3 и щелочей.
Трифторид ScF3: устойчивая тритон. модификация образуется при получении ScF3 термич. разложением (NH4)3 ScF6 при 340-450 °С с послед. плавлением и охлаждением в атмосфере HF; претерпевает полиморфное превращ. при 1350°С; при обезвоживании ScF3·0,16H2O (осажденного из водных р-ров) в интервале 450-500 °С и перегонке в вакууме ScF3 (полученного р-цией Sc с HF под давлением) образуется устойчивая кубич. модификация (а = 0,40137 нм, пространств. группа Pm3m); метастабильная ромбич. модификация получена при нагр. ScF3 при 430 °С и давлении 1000 Па; не раств. в воде (~ 10-5 г в 100 г воды при 20°С), раств. в жидком HF (0,011 г в 100 г HF при О °С); при нагр. во влажном воздухе выше 300 °С последовательно превращ. в ScOF и Sc2O3.
Трихлорид ScCl3 хорошо раств. в воде (43,2% по массе при 25 °С), спиртах, ацетоне, глицерине; образует кристаллогидраты ScCl3 · n Н2 О, где n = 6,5, аддукты с азот- и кислородсодержащими орг. лигандами и др. Получают ScCl3 хлорированием Sc2O3 хлором в присут. угля при 1000°С, с добавкой серы при 1200°С, смесью Сl2 и S2Cl2 при 800 °С или CCl4 при 750-800 °C. Известны также гидроксо- и оксо-хлориды Sc(OH)Cl·nН20, где n = 4, 3, 1, SсОСl·Н2O.
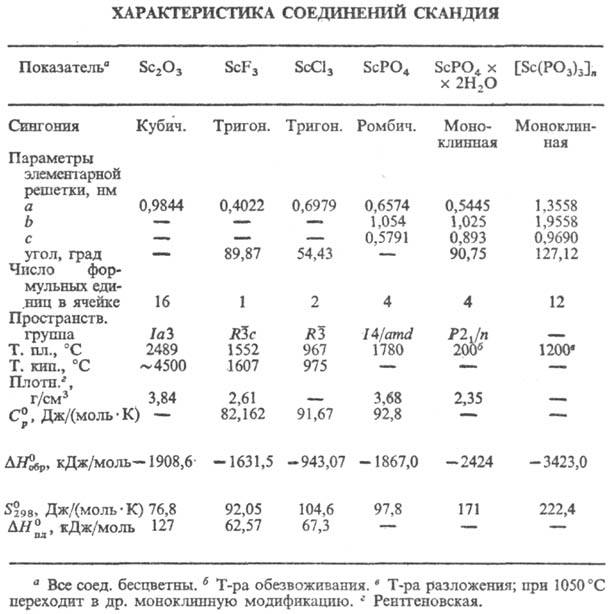
Ортофосфат ScPO4 не раств. в воде (3,4·106 моль/л при 25°С), раств. в соляной к-те (1,0·10-3-4,0·10-4 моль/л при 25°С) и разб. H2SO4 (0,5·10-2-1,2·10-3 моль/л при 25 °С); получают взаимод. Sc2O3 с конц. Н3РО4 при 400 °С или с (МН4)2НРО4 при 950-1200 °С, разложением Sс2(НРО3)3. Полифосфат скандия [Sc(PO3)3]n не раств. в воде (0,2·10-5 моль/л при 25 °С), незначит.'раств. в соляной и бромистоводородной к-тах.
Р-римые в воде соединения скандия-хлорид, нитрат, перхлорат, сульфат, ацетат и др.; гидролизуются водой, выделяются в виде гидратов.
Получение. Осн. источники получения скандия-отходы произ-в W, Sn, Al, Ti, V, а также чугуна, При гидро- и пирометаллургич. переработке руд скандия концентрируется в отвалах или шлаках (содержание Sc2O3 0,01-0,5%). Отходы и шлаки обычно вскрывают кислотным методом. Наиб. эффективный метод концентрирования и очистки скандия - экстракция. Компактный металл (99,5% Sc и выше) получают каль-циетермич. восстановлением SсСl3 или ScF3 с послед, перегонкой металла в высоком вакууме (~1,3·10-4 Па) при 1600-1700 °C.
Скандий-компонент легких сплавов с высокой прочностью и коррозионной устойчивостью на основе Mg, Al, Ti, легирующая добавка к сплавам на основе Ni, Со, Сr, Mo, W, Zr и др., геттер. Оксид скандия применяют в произ-ве ферритов для запоминающих устройств в ЭВМ, искусств. гранатов, эмиттеров (на основе 3ВаО · 2Sc2O3) для электровакуумных приборов, твердых электролитов (вместе с ZrO2), как компонент керамич. материалов и огнеупорных покрытий и др. Ортофосфат скандия-основа флуоресцирующих составов, активированных Сu, Мn и др.
Существование скандия предсказано Д. И. Менделеевым в 1870; он открыт Л.Нильсоном в 1879.
Лит.: Мельников П. П., Комиссарова Л. Н., "Координац. химия", 1988, т. 14, № 7, с. 875-99; Минерально-сырьевые ресурсы скандия и технология извлечения. Сборник обзорной информации Министерства геологии СССР, М., 1989; Scandium, L.-[a.o.], 1975. Л. Н. Комиссарова.
