Кальция оксид
КАЛЬЦИЯ ОКСИД СаО, бесцв. кристаллы с кубич. решеткой (а = 0,4812 нм, z = 4, пространств. группа Fm3m); т. пл. 2627 °С, т. кип. 2850 °С; плотн. 3,37 г/см3; С°з 42,05 Дж/(моль.К); DH0обр -635,09 кДж/моль, DH0пл 52 кДж/моль; S0298 38,10 Дж/(моль.К). Техн. продукт наз. негашеной известью. Энергично взаимод. с водой, образуя гидроксид Са (ОН)2 (техн. продукт -гашеная известь, пушонка), метанолом (при 80 °С) и глицерином (при 100°С). При нагр. реагирует с SiO2, Al2O3, Fe2O3 и др. оксидами. С к-тами образует соли. Восстанавливается до металла натрием, К, Mg, Al и др. при высокой т-ре. С Сl2 и Вr2 образует соотв. СаСl2 и СаВr2. При нагр. реагирует также с S, Р, С и др. элементами. Кальция оксид получают обжигом известняка при 900-1000 °С, особо чистый - разложением Ca(NO3)2. Применяют для получения вяжущих материалов, хлорной извести, соды, гидроксида, карбида и др. соед. Са; в качестве флюса в металлургии; как катализатор в орг. синтезе. Гидроксид Са(ОН)2 - бесцв. кристаллы с гексагон. решеткой (а = 0,35853 нм, с = 0,4895 нм, z = 1, пространств. группа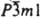 ); плотн. 2,34 г/см3; в природе минерал портландит; плохо раств. в воде (0,1107% по массе). Известны кристаллогидраты с 1 и 0,5 молекулами воды. С СО2 образует СаСО3. Соед. Са(ОН)2 - сильное основание. С к-тами дает соли, с конц. р-рами галогенидов щелочных металлов - соед. типа Ca(OH)2.NaI.H2O. При нагр. разлагается на СаО и воду. Реагирует также с Сl2, превращаясь в хлорную известь, и с СО, образуя формиат Са. Гидроксид Са применяют как вяжущий материал, для получения бордоской жидкости и разл. соед. Са, в сахарной пром-сти для обессахаривания патоки, для раскисления почв, умягчения воды, как компонент шихты в произ-ве стекла и др. См. также Известь.
); плотн. 2,34 г/см3; в природе минерал портландит; плохо раств. в воде (0,1107% по массе). Известны кристаллогидраты с 1 и 0,5 молекулами воды. С СО2 образует СаСО3. Соед. Са(ОН)2 - сильное основание. С к-тами дает соли, с конц. р-рами галогенидов щелочных металлов - соед. типа Ca(OH)2.NaI.H2O. При нагр. разлагается на СаО и воду. Реагирует также с Сl2, превращаясь в хлорную известь, и с СО, образуя формиат Са. Гидроксид Са применяют как вяжущий материал, для получения бордоской жидкости и разл. соед. Са, в сахарной пром-сти для обессахаривания патоки, для раскисления почв, умягчения воды, как компонент шихты в произ-ве стекла и др. См. также Известь. Литература
Рипан Р., Четяну И., Неорганическая химия, пер. с рум., т. 1, М., 1971. с. 202-05. В. П. Данилов.
Синонимы/примеры:*
Негашёная известь; жжёная известь; кипелка
*подобраны ИИ, возможны неточности
Ещё по теме
Кальция оксид — основные характеристики
Кальция гидроокись — свойства и применение
Кальция окись — свойства и применение
Гидроксид кальция — характеристики и применение
Кальция сульфат — свойства и применение
Свойства и применение щелочноземельных металлов
Гидрид кальция — основные характеристики
Кальция хлорид — свойства и применение
Кальций — свойства, применение и роль в организме
Кальция карбонат — свойства и применение
Кальция сульфат — характеристики и применение
Кальция силикат — характеристики и свойства
Кальция пероксид — свойства и применение
Кальция иодид — характеристики и свойства
