Органические соединения металлов третьей группы
В этих соединениях в некоторой степени повторяются свойства металлоорганических соединений, образуемых металлами второй группы. Для алюминия известны первичные, вторичные и третичные (полные) производные:
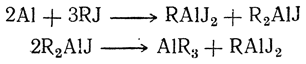
Триметилалюминий Аl(СН3)3 — воспламеняющаяся на воздухе жидкость с т. кип. 130° С, триэтилалюминий Al(С2Н5)3 кипит при 194° С. В парах они имеют удвоенный молекулярный вес. Легко образуют молекулярные соединения — эфираты, 4AlR3 · 3(C2H5)2O.
При помощи алюминийорганических соединений оказалось возможным осуществлять ряд важных технических синтезов: получать высшие предельные первичные спирты, полиэтилен неразветвленного строения и др. Благодаря этому алюминийорганические соединения приобрели важное промышленное значение. Открытие простых способов получения алюминийорганических соединений и оригинальных синтезов с их помощью является заслугой К. Циглера с сотр.
Первоначально Циглер показал, что триалкилалюминий (а также его замещенные производные) легко образуется путем присоединения этилена (или 1,1-двузамещенных этиленов) к гидриду алюминия:
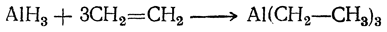
В дальнейшем оказалось, что триалкилалюминий можно получать и непосредственно взаимодействием олефина, водорода и мелко раздробленного алюминия при 100—120° С под давлением. Например:
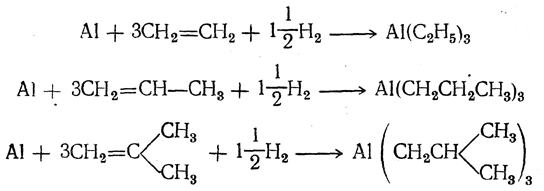
Образующийся триалкилалюминий легко вступает в реакцию с избыточным олефином, что приводит к полимеризации олефинов. Чтобы избежать этого, реакцию вначале ведут при избытке алюминия, затем путем добавления водорода превращают весь образовавшийся триалкилалюминий в диалкилалюминийгидрид
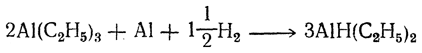
после чего вводят новые порции олефина и при температуре ниже 100° С превращают диалкилалюминийгидрид в триалкилалюминий:
АlН(С2Н5)2 + СН2=СН2 → Аl(С2Н5)3
Таким образом удается получить индивидуальный триалкилалюминий.
Следует отметить, что указанные реакции протекают только с олефинами, имеющими двойную связь у концевого атома углерода, причем алюминий всегда присоединяется именно к этому концевому углеродному атому.
В последние годы много внимания уделяется борорганическим соединениям. В алифатическом ряду наиболее широко изучены эфиры борсодержащих кислот В(OR)3, RB(OR')2 и R2BOR', а также производные борана ВН3, в том числе галоидированные. Последние получаются действием ВCl3 на различные металлоорганические соединения:
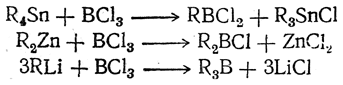
Моно- и диалкилборхлориды легко гидролизуются водой:

Бортриалкилы (триалкилбораны) гораздо труднее гидролизуются, но легче окисляются, чем диалкилборхлориды и алкилбордихлориды. Низшие бортрихлориды самовоспламеняются на воздухе.
Известны алкилбороновые кислоты, обладающие бактерио- и фунгистатическими, а также поверхностно-активными свойствами. Кроме того, некоторые из них способствуют нейтронотерапии опухолей мозга. Добавки бортриалкилов повышают цетановое число дизельного топлива, дают очень высокую скорость истечения при использовании в качестве реактивного топлива.
Интересно, что свойства соединений тяжелого элемента таллия до некоторой степени сходны со свойствами соединений ртути: триэтилталлий Тl(С2Н5)3 (желтая жидкость, кипящая при 129° С) ведет себя как гомеополярное соединение, в то время как смешанный диэтилталлийхлорид (С2Н5)2TlCl (кристаллизуется из воды в виде листочков; вспыхивает, не плавясь, около 190° С) является скорее солью сильного основания (C2H5)2TlOH.


