Способы получения
Во многих случаях способы получения двухосновных кислот являются видоизменениями способов получения одноосновных кислот, причем оба карбоксила могут вводиться в молекулу одновременно или последовательно.
К числу реакций первого типа относятся следующие:
1. Окисление двупервичных г л и к о л е й или диальдегидов. Например, гликоль СН2ОН—СН2ОН и глиоксаль СНО—СНО при окислении дают щавелевую кислоту НООС—СООН.
2. Омыление динитрилов. Так, например, цианистый этилен при омылении дает янтарную кислоту:
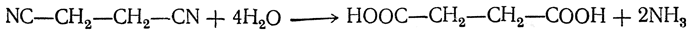
Примерами реакций второго типа являются следующие. 3. Окисление оксикислот с первичноспиртовой группой или альдегидокислот:
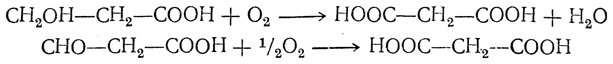
4. Омыление цианзамещенных кислот (мононитрилов двухосновных кислот). Так, например, омылением циануксусной кислоты получается малоновая кислота:
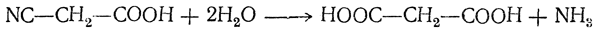
5. Деструктивное окисление. Двухосновные кислоты, как и одноосновные, часто образуются в результате энергичных реакций окисления, идущих с расщеплением молекулы органических веществ. Протекающие реакции, в зависимости от исходных веществ, могут быть отнесены к первому или ко второму типу.
Существуют также специальные синтетические способы получения высших двухосновных кислот из низших.
6. Электролиз солей кислых эфиров двухосновных кислот. Эта реакция аналогична синтезу предельных углеводородов путем электролиза солей жирных кислот. Продуктами реакции здесь являются средние эфиры высших двухосновных кислот:
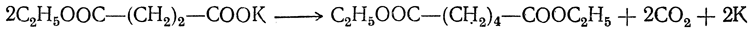
Этим путем из малоновой кислоты и ее гомологов можно получить янтарную кислоту и ее гомологи, из янтарной кислоты и ее гомологов — адипиновую и ее гомологи, из глутаровой кислоты — пробковую и т. д.
7. Синтезы с малоновым эфиром. Чрезвычайно важными синтезами двухосновных кислот являются синтезы при помощи сложных эфиров малоновой кислоты.


