Способы получения
Одноосновные двухатомные оксикислоты могут получаться следующими способами:
1. Окисление г ли колей, содержащих хотя бы одну первичноспиртовую группу (—СН2ОН):
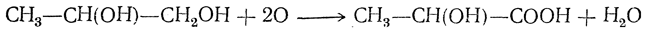
2. Обмен на гидроксил галоида в галоидкислотах:
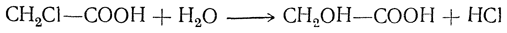
3. Восстановление альдегидокислот и кетонокислот:
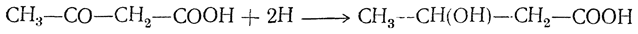
4. Присоединение воды к ненасыщенным кислотам с этиленовой связью:
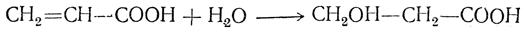
При этом гидроксил присоединяется к атому углерода, дальше отстоящему от карбоксила.
5. Окисление оксиальдегидов:
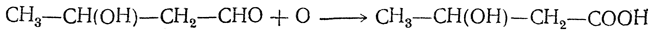
6. Действие азотистой кислоты на аминокислот ы:
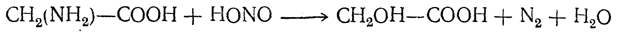
7. Окисление кислот с третичным атомом углерода. В кислотах с третичным атомом углерода водород, находящийся при этом атоме, может окисляться в гидроксил:
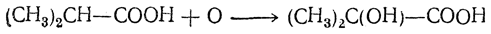
8. Омыление оксинитрилов. Одним из наиболее важных способов получения α-оксикислот является омыление оксинитрилов, получающихся в результате присоединения синильной кислоты к альдегидам и кетонам:
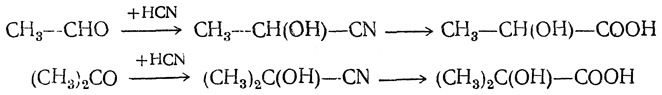
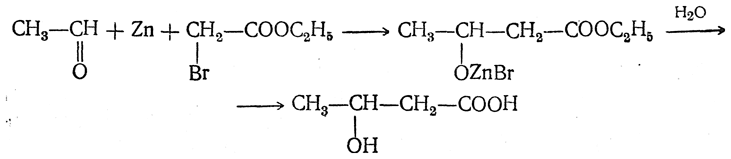
9. Получение при помощи металлоорганических соединений. К числу наиболее старых способов получения оксикислот при помощи металлоорганических соединений относится действие цинкорганических соединений на эфиры двухосновных кислот, и в частности на эфир щавелевой кислоты C2H5OOC—СООС2Н5. Реакции, происходящие при этом, аналогичны реакциям металлоорганических соединений с эфирами одноосновных кислот, но здесь взаимодействует только одна карбэтоксильная группа (ср. стр. 200 сл.). Например, из цинкдиметила и эфира щавелевой кислоты получается соединение
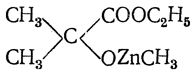
а при действии на это соединение воды — α-оксиизомасляная кислота (СН3)2С(ОН)—СООН. При действии магнийорганических соединений обыкновенно реагируют обе карбэтоксильные группы, и в результате реакции получается гликоль. Довольно часто применяется реакция С. Н. Реформатского (действие цинка и эфиров галоидкислот на альдегиды или кетоны), при которой, по-видимому, в качестве промежуточного продукта образуется цинкорганическое соединение, дающее при действии воды оксикислоту: