Натрия карбонат
НАТРИЯ КАРБОНАТ (кальцинир. сода) Na2CO3, бесцв. кристаллы; до 350 °С существует а-модификация (см. табл.), в интервале 350-479 °С-b с моноклинной кристаллич. решеткой, а выше 479 °С- гексагoн. модификация g (а = 0,5215 нм, с = 0,6584 нм, z = 2, пространств. группа Р63тс); DH0 переходов a b и b
b и b g соотв. 0,80 и 2,1 кДж/моль; т. пл. 858 °С; DH0пл 28 кДж/моль. Гигроскопичен. Р-римость в воде 17,69% по массе (20 °С); DH0 растворения для бесконечно разб. р-ра — 26,65 кДж/моль; р-ры имеют сильнощелочную р-цию. Ниже 32 °С из водных р-ров кристаллизуется декагидрат, в интервале 32-35 °С -гексагидрат, выше 35 °С-моногидрат, а выше 112,5 °С- безводная соль.
g соотв. 0,80 и 2,1 кДж/моль; т. пл. 858 °С; DH0пл 28 кДж/моль. Гигроскопичен. Р-римость в воде 17,69% по массе (20 °С); DH0 растворения для бесконечно разб. р-ра — 26,65 кДж/моль; р-ры имеют сильнощелочную р-цию. Ниже 32 °С из водных р-ров кристаллизуется декагидрат, в интервале 32-35 °С -гексагидрат, выше 35 °С-моногидрат, а выше 112,5 °С- безводная соль.
В природе натрия карбонат встречается в виде грунтовых рассолов, рапы в озерах и минералов-натрона Na2CO3.10Н2О, термонатрита Na2CO3.H2O, троны Na2CO3.NaHCO3 x х 2Н2О. В СССР мощность месторождений природного натрия карбоната ок. 4 млн. т. Крупные запасы натрия карбоната сосредоточены в США, Канаде, Кении, Мексике, ЮАР и др.
Осн. кол-во натрия карбоната получают аммиачно-хлоридным способом (способ Сольвэ): естественный или искусственно приготовленный рассол NaCl очищают от примесей Са и Mg действием Na2CO3 и Са(ОН)2, насыщают NH3, а затем подвергают карбонизации в барботажных колоннах; осн. р-ция:
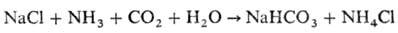
Прокаливанием NaHCO3 получают Na2CO3. Натрия карбонат добывают также из прир. залежей, соляных рассолов. Применяют: как компонент шихты в произ-ве стекла; для получения мыла и др. моющих ср-в, гидроксида Na и др. соед. Na; при варке целлюлозы; для обработки бокситов в произ-ве Аl; для нейтрализации кислых компонентов при очистке нефтепродуктов; для получения пигментов, напр. Fe2O3 из FeCl3. ПДК в воздухе 2 мг/м3.
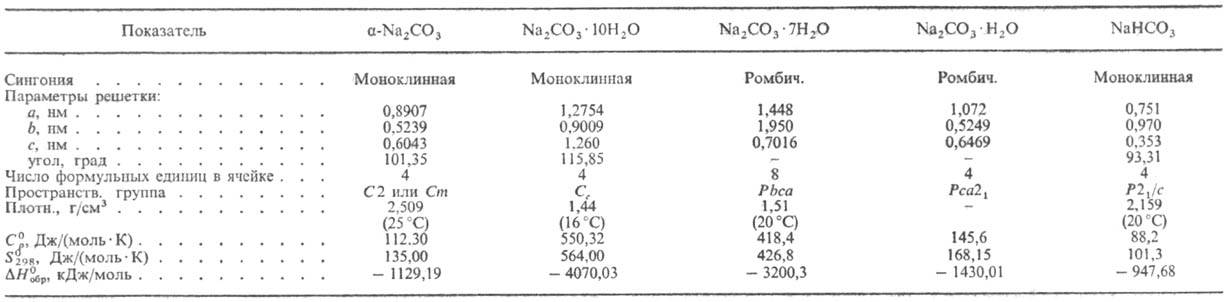
СВОЙСТВА КАРБОНАТА И ГИДРОКАРБОНАТА НАТРИЯ
Г и д р о к а р б о н а т (питьевая, или пищевая, сода) NaHCO3-бесцв. кристаллы; разлагается при 100-150 °С; р-римость (% по массе): в воде-8,8 (20 °С), 14,1 (60 °С); этаноле-1,18 (15,5°С). Получают насыщением СО2 водного р-ра натрия карбоната. Применяют как источник СО2 при выпечке хлеба и изготовлении кондитерских изделий; в произ-ве безалкогольных напитков, искусств. минер. вод, компонент огнету-шащих составов; как лек. ср-во.
Лит.: Баталии Ю. В., Урасип М.А., Шаманский И. Л., Сульфат натрия и природная сода,,М.. 1969. Я. С. Рукк.
