Нитрозила соединения
НИТРОЗИЛА СОЕДИНЕНИЯ, неорг. соед., содержащие группу —NO или ион NO+, называемый нитрозилом или нитрозонием. Переход от молекулы NO (потенциал ионизации 9,27 эВ) к иону NO + сопровождается упрочением и укорочением связи N—О; энергия диссоциации связи увеличивается от 627 до 1047 кДж/моль, длина связи сокращается от 0,11507 до 0,1063 нм. В ковалентных нитрозила соединениях NOX, где X = F, Сl, Вr, положит. заряд на атоме N значительно ниже единицы, а длина связи N—О имеет промежут. значение между длинами связей в NО+ и NO. Так, в NOF длина связи N—О 0,1136 нм, в NOCl-0,1143 нм и в NOBr-0,1146 нм, угол NOX меняется от 110°С в NOF до 114,5°в NOBr.
Н и т р о з и л ф т о р и д NOF-бесцв. газ; т. пл. — 132,5°С, т. кип. ~59,9°С; плотн. 1,326 г/см3. (-59,9°С); С0p 41,5 Дж/(моль.К); DH0обр —65,0 кДж/моль; с безводным HF образует ряд соед. NOF•nHF, где п = 3,4,6 и 7, имеющих строение гидрофторидов NOНnFn+1; для NOH3F4 т. кип. 94 °С, т. пл.-1°С; активный фторирующий агент (напр., в технологии ядерного горючего), в смеси с жидким HF-перспективный р-ритель для металлов и их оксидов.
Н и т р о з и л х л о р и д NOCl-красный газ; т. пл. — 61 °С, т. кип. -5,7°С; C0p 44,6 Дж/(моль.К); DH0обр 52,7 кДж/моль; применяют при нитрозировании алканов, напр., циклогекса-на в произ-ве капролактама. Нитрозилбромид NOBr неустойчив, уже при комнатной т-ре находится в равновесии с продуктами распада: NOBr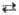 NO + 0,5Br2.
NO + 0,5Br2.
Все нитрозилгалогениды в воде, особенно в щелочной среде, полностью гидролизуются до NO2 и X-; раств. в неводных средах-СНСl3, HF, CH3CN и т.п. Получают нитрозилгалогениды действием галогенидов металлов на оксиды азота или на HNO3, а также р-цией солей нитрозила с галогенидами щелочных металлов.
При взаимод. NOF с акцепторами фторид-иона (к-тами Льюиса), такими как BF3, AsF5, SbF5 и др., образуются соли нитрозония NO + : NOBF4, NOAsF6, NOSbF6, NOPtF6, NOAuF6 и др.; соотв. с NOCl синтезированы NOBCl4, NOAlCl4, NOFeCl4 и др. Нитрозильные соли кислородных к-т получают р-цией NOCl или N2O4 с к-тами. Так выделены NOHSO4, NOHSeO4, NOClO4, NOSO3Cl, (NO)2Se2O7 и др. Соли нитрозония - гигроскопичные кристаллич. ионные соединения. Их используют как окислители для перевода металла в комплексах в более высокую степень окисления, для растворения металлов в неводных средах, напр.:
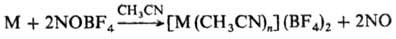
М = Mn, Fe, Co, Ni, Cu, Pd и др.; для введения нитрозо-группы в орг. молекулы.
Известно большое число комплексов переходных металлов, содержащих группу NO в качестве лиганда: [Fe(CN)5NO]2-, [Ir(NO)2(PPh3)2]+ и т.п.; в них группа NO несет отрицат. заряд. B. Я. Росоловский.
