Пероксобораты
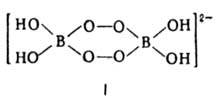
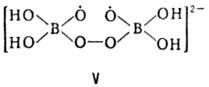
ПЕРОКСОБОРАТЫ (пербораты), соли, анионы к-рых содержат группу В—О—О. В своб. состоянии известны пероксобораты щелочных и щел.-зем. металлов, аммония, Mg и Zn. В литературе используют неск. способов изображения состава пероксоборатов хим. ф-лами, дающими, как правило, неверное представление об их структуре и мол. массе. Так, соль, изображаемая ф-лами MBO3·H2O, MBO2·H2O2 или M2B2O6·2H2O, построена из катионов M+ и ди-m-пероксотетрагидроксодибо-рат-анионов ф-лы I. Шестичленный цикл B2O4 имеет кон-формацию кресла, длина связи О—О 0,1480 нм, В—О 0,1495 нм, В—ОН 0,1442 нм. Этот анион содержат все известные пероксобораты щелочных металлов и Mg как в безводном состоянии, так и в виде тетра- и гексагидратов (M = Na), дигидрата (M = Li), сольватов с одной молекулой CH3OH (M = Ca, Sr) и с двумя молекулами CH3OH (M = Ba).
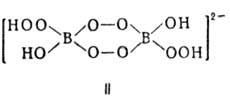
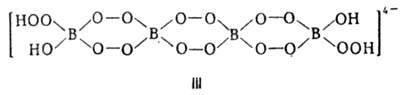
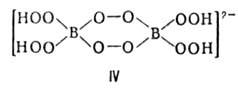
Пероксобораты, изображаемые ф-лами MBO4·H2O, MBO3·H2O2 или M2B2O8·2H2O, где M = Li, Na, К, Ca, Ba (соли щел.-зем. металлов выделены в виде сольватов с CH3OH), содержат анион строения II. Соли состава MBO4·0,5H2O, M2B2O8·H2O, M2B2O7·H2O2 или M4B4O16·2H2O (несольватированные в случае M = Na, К, Rb и Cs, сольваты с CH3OH при M = Ca, Ba) содержат анион III. Наиб. богаты активным кислородом высшие пероксобораты, изображаемые ф-лами MBO5·H2O, MBO4·H2O2 или M2B2O10·2H2O; они содержат анион строения IV. К ним относят пероксобораты Na, Rb и Ba, выделенные в виде сольватов с CH3OH.
Пероксобораты-кристаллы. Кристаллич. структура известна только для Na2[B2(О2)2(OH)4]·6H2O (см. Натрия пероксоборат), а также Li2[B2(O2)2(ОH)4] -кристаллы моноклинной син-гонии (а = 0,7040 нм, b = 0,7880 нм, с = 0,5085 нм, b = 97,98°, z = 2, пространств, группа P21/c), рентгеновская плотн. 1,997 г/см3.
В водном р-ре пероксобораты подвергаются обратимому гидролизу:
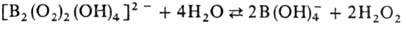
В обычных условиях пероксобораты стабильны. При быстром нагревании (~ 10 град/мин) пероксобораты щелочных металлов в интервале 150-200 0C теряют воду и O2 и превращ. в метабораты MBO2. Если пероксобораты щелочных металлов нагревать медленно (~ 0,1 град / мин), потеря воды происходит при т-ре ок. 60-130 0C и образуются твердые слегка окрашенные в-ва, обладающие сильным парамагнетизмом и выделяющие O2 при контакте с водой. Такие в-ва получили назв. "псевдосу-пероксиды" или "шипучие магн. пероксобораты", их парамагнетизм обусловлен присутствием в решетке анион-радикалов предполагаемого строения V и, возможно, небольшого кол-ва 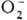 и
и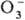
В среде 70-92%-ного H2O2 в результате сольволиза тет-рафтороборатов в р-ре образуются три фторогидропероксо-боратных аниона [BFn(OOH)4_n]-, где n = 3, 2 и 1; в аналогичных условиях M[B(OH)4], наряду с разнолиганд-ными боратами, дает анион [B(OOH)4]. Сообщалось о выделении кристаллич. в-ва Ba (BO4·2H2O2 )2 или, что то же самое, Ba[B(OOH)4],.
В пром-сти производят только пероксобораты Na и К. Пероксобораты щелочных металлов получают кристаллизацией из водных р-ров, содержащих соответствующий борат и H2O2. Высшие пероксобораты получены р-цией (CH3O)3B и трет-бутилатов металлов с 85%-ным H2O2 в трет-бутаноле. Применяют пероксобораты в качестве отбеливателей, компонентов моющих и дезинфицирующих ср-в, мягких окислителей при окраске тканей. Мировое произ-во пероксоборатов превышает 0,5 млн. т/год (1975).
Лит.: Во льнов И. И., Пероксобораты, M., 1984.
В. Я. Росоловский.
