Пируваткарбоксилаза
ПИРУВАТКАРБОКСИЛАЗА, фермент класса лигаз, катализирующий обратимую р-цию образования щавеле-воуксусной к-ты (оксалоацетата) из пировиноградной (пирувата):
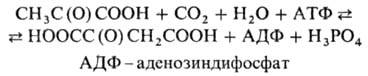
Равновесие р-ции сдвинуто вправо. Кофермент пируваткарбоксилазы-биотин, связанный с e-аминогруппой остатка лизина, к-рый расположен в активном центре фермента. АТФ участвует в р-ции в виде Mg-соли.
Пируваткарбоксилаза обнаружена только у животных. Фермент из печени цыпленка состоит из 4 тетрамеров, содержащих по 4 идентичные субъединицы с мол. м. ок. 40 тыс. (мол. м. всей молекулы ок. 660 тыс.). Каждый тетрамер содержит одну молекулу биотина и один ион Mn2+. Для пируваткарбоксилазы характерна аллостерич. регуляция активности (регуляторный участок находится не на той субъединице, где находится активный центр фермента).
Р-ция, катализируемая пируваткарбоксилазой,-наиб. важная в обеспечении пополнения промежут. в-вами трикарбоновых кислот цикла (такие р-ции наз. анаплеротическими), имеет большое значение для глюконеогенеза.
Аллостерич. регулятор (активатор) р-ции-ацетил-кофер-мент А. Под его влиянием происходит ассоциация малоактивных тетрамеров в нативную молекулу пируваткарбоксилазы (на холоду фермент диссоциирует на 4 тетрамера). Избыток активатора стимулирует образование в митохондриях щавелевоуксус-ной к-ты, что, в свою очередь, обусловливает увеличение скорости синтеза из последней и ацетил-кофермента А лимонной к-ты.
У бактерий и зеленых растений синтез щавелевоуксусной к-ты происходит с помощью др. фермента - фосфоенол-пируваткарбоксилазы.
Лит.: Диксон M., Уэбб Э., Ферменты, пер. с англ., т. 2, гл. 10, M., 1982, с. 732-75; Страйер Л., Биохимия, пер. с англ., т. 2, M., 1985, с. 107-109.
3. С. Kaгaн.
