Глюконеогенез
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пи-ровиноградная кислоты, так называемые гликогенные аминокислоты, гли-церол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот.
У позвоночных наиболее интенсивно глюконеогенез протекает в клетках печени и почек (в корковом веществе).
Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только 3 реакции гликолиза (гексокиназная, фосфо-фруктокиназная и пируваткиназная) необратимы, поэтому в процесс глю-конеогенеза на 3 этапах используются другие ферменты. Рассмотрим путь синтеза глюкозы из пирувата.
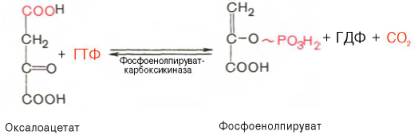
Образование фосфоенолпирувата из пирувата. Синтез фосфоенолпирувата осуществляется в несколько этапов. Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата:

Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ):
Установлено, что в процессе образования фосфоенолпирувата участвуют ферменты цитозоля и митохондрий.
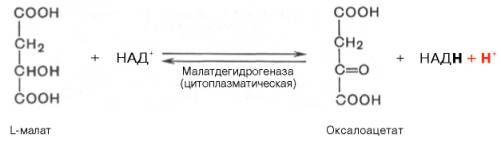
Первый этап синтеза протекает в митохондриях (рис. 10.6). Пируват-карбоксилаза, которая катализирует эту реакцию, является аллостери-ческим митохондриальным ферментом. В качестве аллостерического активатора данного фермента необходим ацетил-КоА. Мембрана митохондрий непроницаема для образовавшегося оксалоацетата. Последний здесь же, в митохондриях, восстанавливается в малат:

Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. В митохондриях отношение НАДН/НАД+ относительно велико, в связи с чем внутримитохондриальный оксалоацетат легко восстанавливается в малат, который легко выходит из митохондрии через митохондриальную мембрану. В цитозоле отношение НАДН/НАД+ очень мало, и малат вновь окисляется при участии цитоплазматической НАД-зависимой малатдегидрогеназы:
Дальнейшее превращение оксалоацетата в фосфоенолпируват происходит в цитозоле клетки.
Превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат. Фосфо-енолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бисфосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой эндергонической реакции. Превращение фруктозо-1,6-бис-фосфата во фруктозо-6-фосфат катализируется специфической фосфатазой:
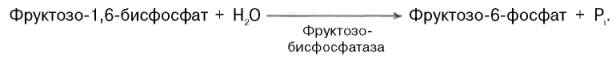
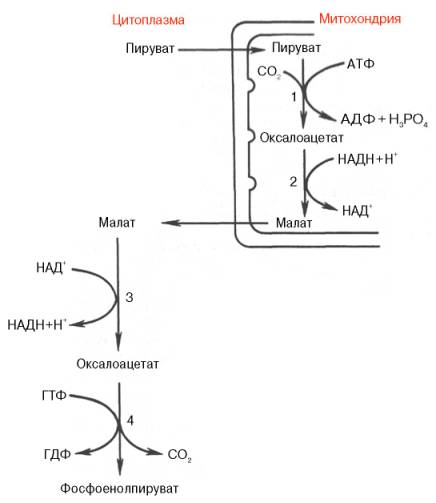
Рис. 10.6. Образование фосфоенол-пирувата из пирувата. 1 - пируваткарбоксилаза; 2 - малатде-гидрогеназа (митохондриальная); 3 -малатдегидрогеназа (цитоплазматиче-ская); 4 - фосфоенолпируват-карбокси-киназа.
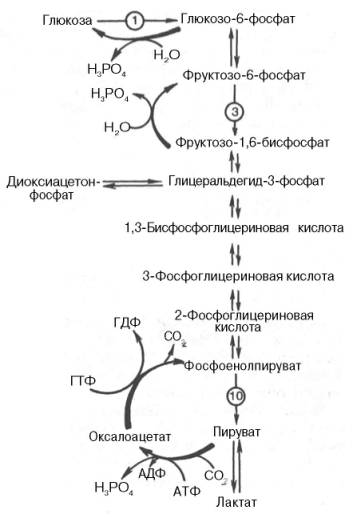
Рис. 10.7. Гликолиз и глюконеогенез. Красными стрелками указаны «обходные» пути глюконеогенеза при биосинтезе глюкозы из пирувата и лактата; цифры в кружках обозначают соответствующую стадию гликолиза.
Образование глюкозы из глюкозо-6-фосфата. В последующей обратимой стадии биосинтеза глюкозы фруктозо-6-фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6-фосфатазы:

На рис. 10.7 представлены «обходные» реакции глюконеогенеза при биосинтезе глюкозы из пирувата и лактата.
Регуляция глюконеогенеза. Важным моментом в регуляции глюконеоге-неза является реакция, катализируемая пируваткарбоксилазой. Роль положительного аллостерического модулятора этого фермента выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил-КоА одновременно является отрицательным модулятором пируватдегидроге-назного комплекса (см. далее). Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению последнего в глюкозу.
Другой важный момент в регуляции глюконеогенеза – реакция, катализируемая фруктозо-1,6-бисфосфатазой – ферментом, который ингибиру-ется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т. е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ мала, в клетке наблюдается расщепление глюкозы.
В 1980 г. группой бельгийских исследователей (Г. Херс и др.) в ткани печени был открыт фруктозо-2,6-бисфосфат, который является мощным регулятором активности двух перечисленных ферментов:
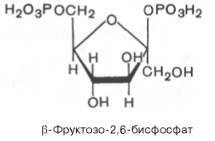
Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бисфосфатазу. Повышение в клетке уровня фруктозо-2,6-бис-фосфата способствует усилению гликолиза и уменьшению скорости глю-конеогенеза. При снижении концентрации фруктозо-2,6-бисфосфата отмечается обратная картина.
Установлено, что биосинтез фруктозо-2,6-бисфосфата происходит из фруктозо-6-фосфата при участии АТФ, а распадается он на фруктозо-6-фосфат и неорганический фосфат. Биосинтез и распад фруктозо-2,6-бис-фосфата катализируется одним и тем же ферментом, т.е. данный фермент бифункционален, он обладает и фосфокиназной, и фосфатазной активностью:
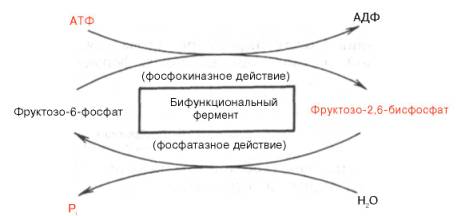
Показано также, что бифункциональный фермент в свою очередь регулируется путем цАМФ-зависимого фосфорилирования. Фосфорилирова-ние приводит к увеличению фосфатазной активности и снижению фосфо-киназной активности бифункционального фермента. Этот механизм объясняет быстрое воздействие гормонов, в частности глюкагона, на уровень фруктозо-2,6-бисфосфата в клетке (см. главу 16).
Активность бифункционального фермента регулируется также некоторыми метаболитами, среди которых наибольшее значение имеет гли-церол-3-фосфат. Действие глицерол-3-фосфата на фермент по своей направленности аналогично эффекту, который наблюдается при его фосфори-лировании с помощью цАМФ-зависимых протеинкиназ.
В настоящее время фруктозо-2,6-бисфосфат, помимо печени, обнаружен и в других органах и тканях животных, а также у растений и микроорганизмов.
Показано, что глюконеогенез может регулироваться и непрямым путем, т.е. через изменение активности фермента, непосредственно не участвующего в синтезе глюкозы. Так, установлено, что фермент гликолиза пиру-ваткиназа существует в 2 формах – L и М. Форма L (от англ. liver – печень) преобладает в тканях, способных к глюконеогенезу. Эта форма ингиби-руется избытком АТФ и некоторыми аминокислотами, в частности ала-нином. М-форма (от англ. muscle – мышцы) такой регуляции не подвержена. В условиях достаточного обеспечения клетки энергией происходит инги-бирование L-формы пируваткиназы. Как следствие ингибирования замедляется гликолиз и создаются условия, благоприятствующие глюконеоге-незу.
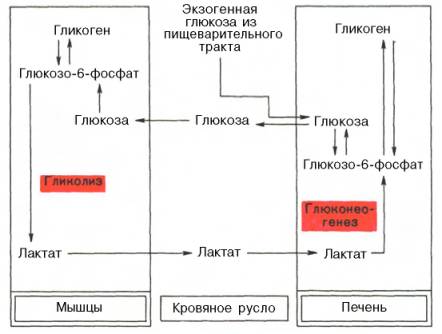
Наконец, интересно отметить, что между гликолизом, интенсивно протекающим в мышечной ткани при ее активной деятельности, и глюко-неогенезом, особенно характерным для печеночной ткани, существует тесная взаимосвязь. При максимальной активности мышц в результате усиления гликолиза образуется избыток молочной кислоты, диффундирующей в кровь, в печени значительная ее часть превращается в глюкозу (глюконеогенез). Такая глюкоза затем может быть использована как энергетический субстрат, необходимый для деятельности мышечной ткани. Взаимосвязь между процессами гликолиза в мышечной ткани и глюконеогенезом в печени может быть представлена в виде схемы: