Биотин
БИОТИН (витамин Н), мол. м. 244,3; один из витаминов группы В; кофермент, участвующий в карбоксилировании орг. к-т. С ферментами связан пептидной связью, образованной его карбоксильной группой и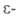 аминогруппой остатка лизина в молекуле апофермента. Из 8 оптич. изомеров и 4 рацематов биол. активностью обладает только ( + )-биотин (см. ф-лу).
аминогруппой остатка лизина в молекуле апофермента. Из 8 оптич. изомеров и 4 рацематов биол. активностью обладает только ( + )-биотин (см. ф-лу). 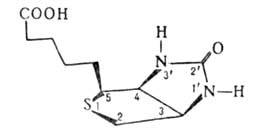
Биотин - кристаллич. в-во; т. пл. 232,5 °С (с разл.);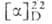 +92° (0,1 н. NaOH); хорошо раств. в разб. р-рах щелочей, плохо - в воде и этаноле (соотв. 22 и 88 мг в 100 мл при 25°С), не раств. в этиловом эфире и хлороформе. Не разлагается при нагревании в разб. р-рах к-т и оснований. Легко окисляется до сульфоксида и сульфона. Ниже приведены наиб. важные р-ции, происходящие в организме с участием биотина. 1. Карбоксилирование уксусной к-ты в виде ацетил-КоА (КоА - остаток кофермента А) с образованием малонил-КоА:
+92° (0,1 н. NaOH); хорошо раств. в разб. р-рах щелочей, плохо - в воде и этаноле (соотв. 22 и 88 мг в 100 мл при 25°С), не раств. в этиловом эфире и хлороформе. Не разлагается при нагревании в разб. р-рах к-т и оснований. Легко окисляется до сульфоксида и сульфона. Ниже приведены наиб. важные р-ции, происходящие в организме с участием биотина. 1. Карбоксилирование уксусной к-ты в виде ацетил-КоА (КоА - остаток кофермента А) с образованием малонил-КоА:
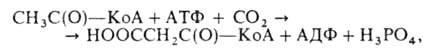
где АТФ - аденозинтрифосфат, АДФ - аденозиндифосфат. Эта р-ция, катализируемая ацетил-КоА-карбоксилазой,— важнейший этап в биосинтезе жирных к-т.
2. Карбоксилирование пропионовой к-ты в виде пропионил-КоА, в результате чего последний превращается в метилмалонил-КоА: 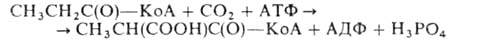
Р-ция катализируется пропионил-КоА-карбоксилазой и обеспечивает утилизацию пропионовой к-ты, образующейся при окислении жирных к-т с разветвленным углеродным скелетом или с нечетным числом атомов С и в других р-циях.
3. Карбоксилирование пировиноградной к-ты с образованием щавелевоуксусной к-ты (оксалоацетата): 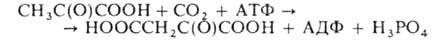
С помощью этой р-ции, катализируемой пируваткарбок-силазой, осуществляется непрерывное пополнение щавелевоуксусной к-ты, необходимой для бесперебойной работы цикла трикарбоновых к-т. Кроме того, эта р-ция - начальный этап глюконеогенеза.
В приведенных р-циях биотин осуществляет активацию СО2 путем ее присоединения к атому N в положение Г и послед. перенос активной СО2 на акцептор.
Биотин широко распространен в природе. Особенно богаты им печень и почки (200-250 мкг в 100 г), а из растит. продуктов - зерна ржи (46 мкг) и цветная капуста (17 мкг). Кулинарная обработка пищ. продуктов практически не разрушает биотин. Признаки дефицита биотина у человека - пепельная бледность лица и шелушение кожи, атрофия вкусовых сосочков языка, мышечные боли, облысение. У животных выпадает шерсть, появляются дерматит, отек конечностей, гипогликемия и др.
Биотин синтезируют из производных имидазола или тиофена, наращивая соотв. тиофеновый или имидазольный цикл. Его применяют в медицине при циррозе печени, сахарном диабете и нек-рых др. заболеваниях. Потребность в нем взрослого человека -150-200 мкг/сут, в период беременности и лактации у женщин - 250-300 мкг/сут. Значительная часть потребности человека в биотине обеспечивается в результате его синтеза микрофлорой кишечника, в связи с чем недостатка биотина в обычных условиях у человека не наблюдается. В сыром яичном белке присутствует гликопротеин авидин, связывающий биотин в прочный комплекс и нарушающий утилизацию биотина организмом. В связи с этим прием в пищу больших кол-в сырых яиц может вызвать недостаточность биотина.
Количественно биотин можно определить спектрофотометрич. методами. Один из них основан на его гидролизе в конц. р-ре минер. к-ты и взаимод. образующейся диаминокарбоновой к-ты с нингидрином, другой - на взаимод. с n-диметиламинокоричным альдегидом. Чувствительность методов соотв. 100 и 10мкг/мл. Более чувствительны (0,025-0,5 мкг/мл) микробиол. методы.
Литература
Розанов А. Я., К и риле н ко О. А., в кн.: Экспериментальная витаминология, Минск, 1979, с. 321-44. В. Б. Спиричев.
