Полоний
ПОЛОНИЙ (от лат. Polonia-Польша, родина М. Скло-довской-Кюри; лат. Polonium) Po, радиоактивный хим. элемент VI гр. периодич. системы, ат. н. 84, ат. м. 208,9824. Стабильных изотопов не имеет. Известно 27 изотопов с мас. ч. 192-218. Наиб. долгоживущие изотопы: 209Ро(T1/2102 года), 208Ро (Т1/2 2,9 года) и 210Ро (Т1/2 138,3 сут) - a-излучатели. Изотопы с маc. ч. 210-218 входят в прир. радиоактивные ряды. Конфигурация внеш. электронных оболочек атома 5s25p65d106s26p4; степени окисления — 2, +2, +4 (наиб. устойчивая) и +6; электроотрицательность по Полингу 1,76; атомный радиус 0,153 нм, ионные радиусы (расчетные) для Ро6+ 0,067 нм, Ро4+ 0,104 нм. Содержание в земной коре ок. 2·10 -14% по массе.
Свойства. Полоний - мягкий серебристо-белый металл. Известны две кристаллич. модификации полония: низкотемпературная a-форма с кубич. решеткой, а = 0,3359 нм; b-форма, устойчивая выше 36 °С, решетка ромбоэдрич., а = 0,3366 нм, а = 98,08°; т. пл. 254 °С, т. кип. 949 °С; вычисленная плотн. 9,136 г/см3;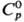 26,4 Дж/(моль·К);
26,4 Дж/(моль·К);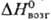 72,8 кДж/моль;
72,8 кДж/моль; 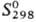 62,8 ДжДмоль • К); ур-ние температурной зависимости давления пара металлического полония: 1gp(атм) = 4,553-5778/Т. На воздухе окисляется; реагирует с р-рами к-т с образованием ионов Ро(II) (розового цвета), к-рые быстро окисляются до Po(IV) (желтого цвета); с Н2 дает летучий гидрид РоН2. Известны полониды металлов, к-рые получают нагреванием соответствующих металлов с парами полония при 400-1000°С. Характеристики нек-рых полонидов приведены в таблице.
62,8 ДжДмоль • К); ур-ние температурной зависимости давления пара металлического полония: 1gp(атм) = 4,553-5778/Т. На воздухе окисляется; реагирует с р-рами к-т с образованием ионов Ро(II) (розового цвета), к-рые быстро окисляются до Po(IV) (желтого цвета); с Н2 дает летучий гидрид РоН2. Известны полониды металлов, к-рые получают нагреванием соответствующих металлов с парами полония при 400-1000°С. Характеристики нек-рых полонидов приведены в таблице.
Диоксид РоО2 существует в двух кристаллич. модификациях: ниже 54°С-в желтой форме с гранецентрир. кубич. решеткой (а = 0,5638 нм); при более высокой т-ре-в красной форме с тетрагон, решеткой (а = 0,545 нм, с = = 0,836 нм); разлагается при 500 °С в вакууме, восстанавливается до металла водородом или HN3 при 250 °С; получают нагреванием металла в атмосфере О2 при 250 °С дегидратацией гидроксида полония при той же т-ре и нагреванием сульфатов или селенатов полония выше 550 °С. Известен монооксид РоО-твердое в-во черного цвета, образуется при самопроизвольном разложении PoSO3 или PoSeO3. Термин, разложением соответствующих галогенидов Po(IV) при 200 °С в вакууме или их восстановлением водородом при 200°С, SO2 и H2S при 25°С получают дихлорид РоС12 (темные рубиново-красные кристаллы с ромбич. решеткой, а = 0,366 нм, b = 0,434 нм, с = 0,449 нм), дибромид РоВr2 (пурпурно-коричневые кристаллы).
| ХАРАКТЕРИСТИКА ПОЛОНИДОВ | |||||||
| Соединение | Сингония | Параметры | решетки | Плотн. (расчетная), г/см3 | Т. разл., | ||
| а, им | с, нм | ||||||
| РbРо | Кубич. | 0,659 | - | 9,6 | 600 | ||
| HgPo | To же | 0,625 | — | 11,1 | — | ||
| ZnPo | — "— | 0,628 | — | 7,39 | 400* | ||
| Na2Po | — "— | 0,747 | — | 4,08 | — | ||
| PtPo | Гексагон. | 0,4104 | 0,1366 | 12,47 | 450-600 | ||
| NiPo | То же | 0,3973 | 0,1425 | 11,53 | — | ||
| BePo | Кубич. | 0,5827 | — | 7,35 | - | ||
| BaPo | То же | 0,7119 | — | 6,3 | — | ||
| CaPo | — "— | 0,6514 | — | 6,0 | — | ||
| MgPo | Гексагон. | 0,4345 | 0,7060 | 6,7 | — | ||
| * T-pa возгонки. | |||||||
Тетрахлорид РоС14-ярко-желтые кристаллы с моноклинной решеткой; т. пл. 300 °С, т. кип. 390°С. Тетрабромид РоВr4-ярко-красные кристаллы; т. пл. 330 °С, т. кип. 360°С/200 ммрт.ст. Тетраиодид РоI4-летучее в-во черного цвета. Тетрагалогениды полония раств. в этаноле, ацетоне. Синтезируют тетрагалогениды взаимод. металлического полония соотв. с сухим С12 при 200 °С, парами Вr2 при 250 °С, действием сухого I2 на РоО2 при 200 °С. Упариванием р-ров РоС14 с соответствующим галогенидом одновалентного металла или нагреванием РоС14 с галогенидом аммония получены гексахлорополонаты: Cs2[PoCl6]-кристаллы с гранецентрир. кубич. решеткой (a=1,059нм), (NH4)2[PoCL] с кубич. решеткой (а = 1,033 нм) и [(CH3)4N]2[PoCl6]-c кубич. решеткой.
В кислых водных р-рах стандартные электродные потенциалы для пары Po(II)/Po(IV) 0,798 В, для Po(II)/Po(VI) 1,16 В, для Po(IV)/Po(VI) 1,524 В.
Получение. 10Ро в граммовых кол-вах получают облучением металлич. 209Вi нейтронами в ядерных реакторах, а микроколичества полония-из отходов переработки урановых руд. 209Ро образуется при облучении 209Bi протонами в циклотроне. Выделяют полоний экстракцией, ионным обменом, электроосаждением и возгонкой. Металлический полоний получают разложением в вакууме PoS или РоО2 при 500 °С.
Применение. 210Ро-источник энергии в атомных батареях (1 см3 210Ро выделяет 1210 Вт тепловой энергии), к-рые используют в космич. аппаратах, а также в переносных устройствах; в смеси с Be и В полоний применяют для изготовления ампульных источников нейтронов.
Полоний высокотоксичен. ПДК в открытых водоемах и воздухе рабочих помещений соотв. 1,11·10-3 и 7,4·10 -3 Бк/л. Миним. значимая активность 3,7·103 Бк (категория 4).
Впервые полоний выделен из урановой смоляной руды П. Кюри и М. Склодовской-Кюри в 1898.
Лит. Бэгнал К , Химия редких радиоактивных элементов, пер. с англ., М., 1960; Bagnall К W., "Radiochimica Acta", 1983, v 32, № 1-3, p. 153 61
Б. Ф Мясоедов
