Фторофосфаты
ФТОРОФОСФАТЫ, соединения, содержащие анионы гек-сафгорофосфорной HPF6, дифторофосфорной HPO2F2 и MO-нофторофосфорной H2PO3F к-т. Фторофосфаты щелочных, щел.-зем. и др. двухвалентных металлов - типичные соли. Гексафторофос-фаты Li, Na и NH+4 хорошо раств. в воде, К - умеренно, Rb и Cs - плохо. Дифгорофосфаты и монофторофосфаты щелочных металлов и аммония хорошо раств. в воде, фторофосфаты щел.-зем. и др. двухвалентных металлов - плохо. Дифторофосфаты щелочных металлов плавятся при 200-300 0C, а монофторофосфаты - при 600-800 0C.
Гексафторофосфат-ион PF-6 в р-рах солей представляет собой правильный октаэдр. В кристаллич. солях атомы фтора в PF-6 неэквивалентны. По данным рентгеноструктурного анализа, длины связей 2 аксиальных атомов F с атомом P неск. увеличены по сравнению со связями 4 экваториальных.
Анионы PO2F-2 и PO3F2-, в отличие от PF-6, могут не только входить в состав солей, но и образовывать с к-тами Льюиса комплексные соед., устойчивые в орг. р-рителях. Напр., в р-циях с PF5 и AsF5 анион PO2F-2 выступает в роли моноден-татного лиганда, а с более сильной к-той, напр., SbF5,- в качестве мостиковой группы:
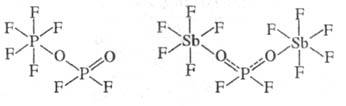
Фторофосфаты получают взаимод. PF5 или PCl5 с фторидами металлов во фтористоводородной к-те или в орг. р-рителях, а также сплавлением P2O5 или фосфатов с соответствующими фторидами. Практич. значение имеют монофторофосфаты как компоненты спец. стекол и зубных паст и гексафторофосфаты как компоненты электролитов хим. источников тока.
Лит.: Буслаев Ю.А., Ильин E. Г., в кн.: Итога науки и техники, сер. Неорганическая химия, т. 10, M., 1987. Е.Г.- Ильин.
