Циановая кислота
ЦИАНОВАЯ КИСЛОТА (цианатная к-та) в своб. виде существует в виде изоформы (изоциановая к-та) HN = C = O, мол. м. 43,03; бесцв. жидкость с резким запахом, напоминающим запах уксусной к-ты; т. пл. от -81 до -79 °С, кристаллы ромбич. сингонии (а = 1,082 нм, b = 0,552 нм, с = 0,357 нм, z = 4, пространств. группа Рата); т. кип. 23,5 °С; давление пара 36,13 кПа (273,16 К);
в своб. виде существует в виде изоформы (изоциановая к-та) HN = C = O, мол. м. 43,03; бесцв. жидкость с резким запахом, напоминающим запах уксусной к-ты; т. пл. от -81 до -79 °С, кристаллы ромбич. сингонии (а = 1,082 нм, b = 0,552 нм, с = 0,357 нм, z = 4, пространств. группа Рата); т. кип. 23,5 °С; давление пара 36,13 кПа (273,16 К);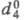 1,140; Ср44,77 Дж/(моль x К) (300 К);
1,140; Ср44,77 Дж/(моль x К) (300 К);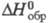 -153,3 кДж/моль,
-153,3 кДж/моль, 28,4 кДж/моль,
28,4 кДж/моль,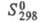 238,5 Дж/(моль x К). Сильная к-та, Ka (водный р-р, 25 °С) 1,9 x 10-4. Образует соли, имеющие гл. обр. изостроение (см. Цианаты неорганические).
238,5 Дж/(моль x К). Сильная к-та, Ka (водный р-р, 25 °С) 1,9 x 10-4. Образует соли, имеющие гл. обр. изостроение (см. Цианаты неорганические).
С NH3 циановая кислота дает цианат аммония NH4NCO, при нагр. превращающийся в мочевину (Н2N)2СО. В водных р-рах циановая кислота гидролизуется:
HNCO + H2O H2NCOOH
H2NCOOH CO2 + NH3
CO2 + NH3
Разб. р-ры циановой кислоты в диэтиловом эфире, бензоле и толуоле устойчивы в течение длит. времени. В спиртовом р-ре циановая кислота превращается в эфиры аллофановой к-ты:
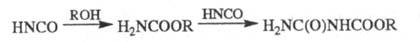
При недостатке циановой кислоты продуктом р-ции является уретан. С ненасыщенными соед. образует изоцианаты:
RCH = СН2 + HNCO RCH2CH2NCO
RCH2CH2NCO
При т-ре ниже 150 °С циановая кислота полимеризуется, в осн. до линейного циамелида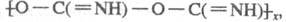 выше 150 °С - до циклич. тримера - циануровой кислоты.
выше 150 °С - до циклич. тримера - циануровой кислоты.
Циановую кислоту обычно получают деполимеризацией очищенной циануровой к-ты (примеси м. б. причиной взрыва) при 400 °С в токе N2. Продукт р-ции конденсируют при -80 °С, встряхивают с Р2О5 и Ag2O для освобождения от следов влаги и HCN и перегоняют в глубоком вакууме. Другие методы - окисление HCN при 630-650 °С на контактной сетке из золота. Циановая кислота -исходный продукт в синтезе цианатов и изоцианатов, уретанов, аллофанатов, семикарбазида и его производных. Токсична.
Лит.: Химия псевдогалогенидов, пер. с нем., К., 1981; Руководство по неорганическому синтезу, пер. с нем., т. 3, М., 1985, с. 694-95.
С. К. Смирнов.
