Литий
Внешний вид:
серебристо-бел. металл Кристаллические модификации, цвет растворов и паров:
 Очень легкий металл - плавает в керосине (на фото).
Очень легкий металл - плавает в керосине (на фото).Брутто-формула (система Хилла): Li
Формула в виде текста: Li
Молекулярная масса (в а.е.м.): 6,94
Температура плавления (в °C): 180,5
Температура кипения (в °C): 1390
Растворимость (в г/100 г или характеристика):
аммиак жидкий: растворимвода: реагирует
ртуть: 0,09 (18°C)
Метод получения 1.
(лабораторный синтез)Источник информации: Ключников Н.Г. "Неорганический синтез" М. 1988 стр. 85
Для получения металлического лития проводят электролиз раствора хлорида лития в безводном пиридине. Для обезвоживания хлорид прокаливают при 550-600°С, пиридин настаивают с сухим гидроксидом калия и с силикагелем-осушителем, а затем перегоняют. При 20°С в пиридине растворяется 11,81% хлорида лития. Электролиз проводят в ванне без диафрагмы с катодом в виде железной пластинки площадью 4-5 см2, анод - угольный стержень. Плотность тока 0,2-0,3 А/дм2. Напряжение на ванне зависит от расстояния между электродами и степени обезвоживания исходных веществ. Литий получается в виде серебристо-белого слоя, плотно приставшего к катоду. Его промывают эфиром, очищают скальпелем и быстро запаивают в ампуле. Литий можно хранить в хорошо закрытой пробирке, доверху наполненной керосином, бензином или петролейным эфиром (он в них всплывает!).
Плотность:
0,534 (20°C, г/см3)0,507 (200°C, г/см3)
0,441 (1000°C, г/см3)
Стандартный электродный потенциал:
Li+ + e- → Li, E = -3,045 В (вода, 25 C)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия образования S (298 К, Дж/моль·K):
29,1 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
24,63 (т)Энтальпия плавления ΔHпл (кДж/моль):
4,2Аналитические
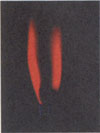 Соли лития окрашивают пламя в карминово-красный цвет (на фото).
Соли лития окрашивают пламя в карминово-красный цвет (на фото).
Дополнительная информация:
Изотопы (в скобках период полураспада и тип распада): 4Li (0,00009 ас; p), 5Li (0,00044 ас; p), 6Li (стабилен, содержание в природной смеси 7,5%), 7Li (стабилен, содержание в природной смеси 92,5%), 8Li (0,842 с; β-), 9Li (0,176 с; β-), 10Li (0,0004 ас; β-), 11Li (8,5 мс; β- (39%), β-n (61%)), 12Li (менее 10 нс).
- "Handbook of Chemistry and Physics" CRC Press, Inc., 2002 стр. 11-51
- "Неорганические синтезы" сб.1 М.: ИИЛ, 1951 стр. 10
- "Физические величины" под ред. Григорьева И.С., Мейлихова Е.З., М.:Энергоатомиздат 1991 стр. 994
- "Энциклопедия для детей" т.17: Химия, М.:Аванта+, 2004 стр. 186-188
- Гурвич Я.А. "Справочник молодого аппаратчика-химика" М.:Химия, 1991 стр. 51, 303
- Девяткин В.В., Ляхова Ю.М. "Химия для любознательных, или о чем не узнаешь на уроке" Ярославль:Академия Холдинг, 2000 стр. 83
