§ 7. Нитриты
Для выделения нитритов из биологического материала применяют метод настаивания исследуемых объектов с водой, который используется для выделения минеральных кислот и щелочей.
Водные вытяжки, полученные при настаивании биологического материала с водой, фильтруют. Полученные фильтраты подвергают диализу. Диализаты доводят до нейтральной реакции, а затем определяют наличие нитритов при помощи реакций с диазо-тированной сульфаниловой кислотой и с реактивом Грисса.
Реакция с сульфаниловой кислотой и β-нафтолом. После подкисления диализатов, содержащих нитриты, выделяется азотистая кислота HNO 2, которая с сульфаниловой кислотой (I) или с другими первичными ароматическими аминами образует соль диазония (II):
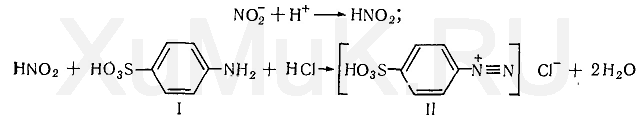
При сочетании полученной соли диазония с β-нафтолом (III) в щелочной среде образуется азокраситель (IV):
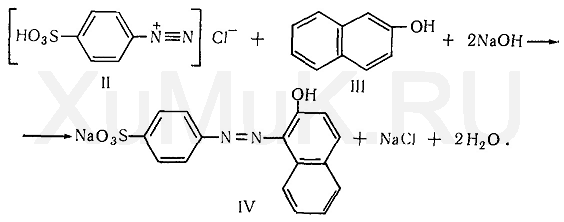
Сочетание солей диазония с фенолами и аминами происходит в параположении по отношению к фенольным или аминным группам. Если параположение занято, то сочетание происходит в орто-положении.
Выполнение реакции. В углублении на капельной пластинке или в маленькую пробирку вносят 1—2 капли нейтрализованного диализата, прибавляют 2—3 капли 0,5 %-го раствора сульфаниловой кислоты в 2 %-й соляной кислоте. После перемешивания этих жидкостей через 3—5 мин прибавляют каплю щелочного раствора β-нафтола. При наличии нитритов в исследуемом растворе появляется интенсивная оранжево-красная окраска. Ин-тенсивость окраски зависит от содержания нитритов в пробе.
Приготовление щелочного раствора β -нафтола (см. Приложение 1, реактив 23).
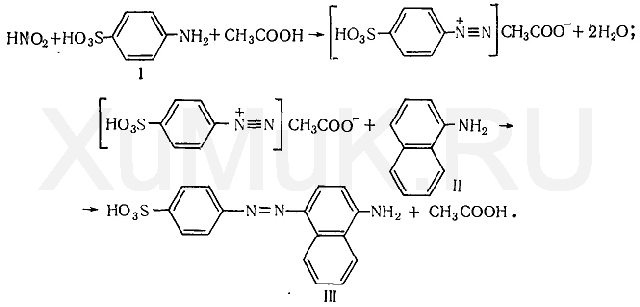
Реакция с реактивом Грисса. Этот реактив состоит из суль-фаниловой кислоты и α-нафтиламина. При взаимодействии реактива Грисса с нитритами образуется азокраситель:
Выполнение реакции. В углубление на капельной пластинке или в маленькую пробирку вносят несколько капель нейтрализованного диализата, а затем прибавляют 3—4 капли реактива Грисса. При наличии нитритов в водной вытяжке сразу или спустя некоторое время появляется интенсивная красная окраска. Интенсивность окраски зависит от количества нитритов в пробе.
Приготовление реактива Грисса (см. Приложение 1, реактив 31).
О наличии нитритов в диализатах свидетельствует появление ярко выраженных окрасок при указанных выше реакциях.
Если при реакции с сульфаниловой кислотой и с реактивом Грисса появляется слабоинтенсивная окраска, то возникает вопрос о возможном появлении окрасок не за счет нитритов, вызвавших отравление, а за счет наличия их в окружающей среде. Б этих случаях проводят отгонку нитритов из диализатов в токе оксида углерода (IV).
Часть подлежащего исследованию диализата вносят в колбу вместимостью 50 мл и подкисляют уксусной кислотой, которая из нитритов вытесняет азотистую кислоту и не вытесняет азотную кислоту из нитратов. После подкисления диализата из аппарата Киппа через колбу пропускают ток оксида углерода (IV), который переносит азотистую кислоту или ее ангидрид в приемник, содержащий 1 %-й раствор гидроксида натрия.
После отгонки азотистой кислоты содержимое приемника нейтрализуют 10 %-м раствором соляной или уксусной кислоты (не допуская избытка этих кислот), а затем в нейтрализованном дистилляте определяют наличие нитритов при помощи описанных выше реакций с реактивом Грисса, с сульфаниловой кислотой и β-нафтолом, а также с помощью реакции окрашивания иод-крахмальной бумажки.
Обнаружение нитритов с помощью иод-крахмальной бумажки.
На иод-крахмальную бумажку наносят каплю 1 %-го раствора соляной кислоты и 3—4 капли нейтрализованного дистиллята. При наличии нитритов в дистилляте иод-крахмальная бумажка синеет.
Приготовление иод-крахмальной бумажки (см. Приложение 1, реактив 4).
При положительных реакциях дистиллята с сульфаниловой кислотой, реактивом Грисса и иод-крахмальной бумажкой делают вывод о наличии нитритов в биологическом материале.
Для решения вопроса о составе нитритов, обнаруженных при помощи указанных выше реакций, производят реакции на катионы натрия и калия. С этой целью берут диализат и поступают так, как указано выше (см. гл. VII, § 4, 5).


