Иридийорганические соединения
ИРИДИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат связь Ir—С. В хим. св-вах иридийорганических соединений наблюдаются сходства и различия со св-вами кобальт- и родийорг. соединений. Степени окисления Ir в иридийорганических соединениях от — 1 до + 5, координац. числа обычно 4-7. Связи металл - углерод, как правило, более прочны, чем в соед. Со и Rh, что приводит к большей устойчивости иридийорганических соединений. Переходы между соед. Ir, отличающимися степенями окисления, координац. числами Ir и (или) природой лигандов, относительно затруднены: по этой причине иридийорганические соединения не находят такого широкого применения в катализе, как орг. соед. Со и Rh. Для Ir, особенно в степени окисления +3, весьма характерны соед. с одной или двумя s-связями Ir—С, входящими в четырех- или пятичленный хелатный цикл, как, напр., в соед. I. Наиб. важные иридийорганические соединения - соед. Ir(I) и Ir(Ш). Соед. Ir(I) с s-связью Ir—С получают обычными методами металлоорг. химии, напр., присоединением к олефинам соед. со связями Ir1—Н, действием литийорг. соед. на комплекс Васка (транс-[Ir(CO)(PPh3)2Cl]) и его аналоги: транс-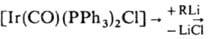 , транс-[Ir(CO)(PPh3)2R], где R - алкил, арил. Для получения соед. Ir(III) с s-связью Ir—С наряду с обычными методами металлоорг. химии используют р-ции окислит. присоединения к соед. Ir(I) - межмолекулярные и внутримолекулярные (циклометаллирование), напр.:
, транс-[Ir(CO)(PPh3)2R], где R - алкил, арил. Для получения соед. Ir(III) с s-связью Ir—С наряду с обычными методами металлоорг. химии используют р-ции окислит. присоединения к соед. Ir(I) - межмолекулярные и внутримолекулярные (циклометаллирование), напр.: 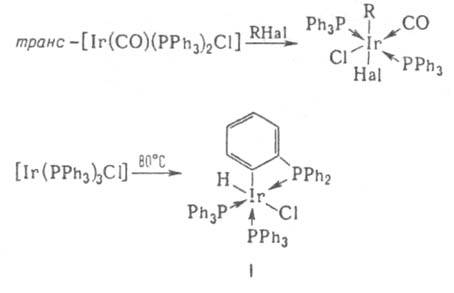
Комплекс Васка (т. пл. 323-325 °С) получают взаимод. IrСl3 или (NH4)2[IrCl6] с PPh3 в 2-(2-метоксиэтокси)этаноле или ДМФА. Нек-рые p-комплексы Ir образуются в результате присоединения непредельных соед. к координационно ненасыщенным комплексам, напр., олефинов к комплексу Васка: транс-[Ir(СО)(РРh3)2Сl] + С2Н4 : [Ir(CO)(PPh3)2(C2H4)Cl]. Эти р-ции обычно обратимы. Часто используют также замещение лигандов, осуществляемое в случае анионных лигандов в восстановит. условиях (напр., замещение остатка ацетилацетона проводят в присут. алюминийорг. соединений). Орг. соединения Ir(V) содержат в качестве лигандов h-С5(СН3)5, а также др. лиганды, являющиеся сильными донорами, напр., в соед. [Ir{h-С5(СН3)5}(СН3)4]. Несмотря на высокую степень окисления Ir, эти соед. не являются типичными окислителями, для них скорее характерны р-ции восстановит. элиминирования и разложения под действием электрофилов, приводящие к понижению степени окисления и координац. числа. В нек-рых случаях даже образуется металлич. иридий.
Литература
Leigh G.J., Richards R. L., в кн.: Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 5, Oxf., 1982; Dickson R.S., Organometallic chemistry of rhodium and iridium, N.Y., 1983. И. Я. Левитин.
Ещё по теме
Ренийорганические соединения — свойства и получение
Иридия (IV) оксид — характеристики и свойства
Рутенийорганические соединения — строение и применение
Иридий — свойства и характеристики металла
Иридий — свойства и применение редкого элемента
Родийорганические соединения — особенности и применение
Уранорганические соединения — особенности и применение
Иридия (VI) фторид — характеристики и применение
Рений — свойства, применение и способы получения
Иридия (II) хлорид — характеристики и свойства
Рений — свойства и применение
Сереброорганические соединения — свойства и методы получения
Иридия (III) хлорид — основные характеристики
Ртутьорганические соединения — свойства, реакции и применение
Оксиды рения — свойства и характеристики
