Тантала оксиды
ТАНТАЛА ОКСИДЫ. Оксид Ta(V) (пентаоксид дитан-тала) Та,О5; до 1360°С устойчив b-Та2О5- бесцв. кристаллы ромбич. сингонии (а = 0,6198 нм, b = 4,029 нм, с = = 0,3888 нм, z =11), т. пл. 1787°С, плотн. 8,18 г/см3, С° 134,9 Дж/(моль · К), 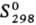 141,9 Дж/(моль · К); выше 1560°С устойчив a-Та2О5-серые кристаллы тетрагон, сингонии (а — 0,381 нм, с = 3,609 нм, z = 6, пространств. группа I41/amd), т. пл. 1887°С, плотн. 8,37 г/см3,
141,9 Дж/(моль · К); выше 1560°С устойчив a-Та2О5-серые кристаллы тетрагон, сингонии (а — 0,381 нм, с = 3,609 нм, z = 6, пространств. группа I41/amd), т. пл. 1887°С, плотн. 8,37 г/см3,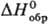 —2047,2 кДж/моль. Обе модификации имеют общие структурные элементы-блоки из октаэдров ТаО6 и искаженных пентагональных бипирамид ТаО7, связанных в трехмерный каркас, но характер сочленения блоков различен. Скорость b
—2047,2 кДж/моль. Обе модификации имеют общие структурные элементы-блоки из октаэдров ТаО6 и искаженных пентагональных бипирамид ТаО7, связанных в трехмерный каркас, но характер сочленения блоков различен. Скорость b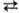 a-перехода (DH ~ 2 кДж/моль) мала. b-Ta2О5-полупроводник, ширина запрещенной зоны 1,79 эВ, r 105 Ом·см (1000 К), переход из р-типа в n-тип-при 1300 К и давлении O2 105 Па.
a-перехода (DH ~ 2 кДж/моль) мала. b-Ta2О5-полупроводник, ширина запрещенной зоны 1,79 эВ, r 105 Ом·см (1000 К), переход из р-типа в n-тип-при 1300 К и давлении O2 105 Па.
Нек-рые примеси (WO3) стабилизируют b-Ta2O5, другие (Sc2O3)-a-Ta2O5 или метастабильные модификации. При очень быстрой закалке от высоких т-р получают d-Та2О5 (близкую к b-форме) гексагон. сингонии (а = 0,3874 нм, с - 0,362 нм). Похожая модификация образуется при кристаллизации аморфного Та2О5. Закалкой от т-р выше 1360°С получена триклинная модификация, близкая a-форме (а = О, 3801 нм, b = 0,3785 нм, с = 3,574 нм, a-90,91°, b-90,19°, g-90°), к-рая при 317°С превращается в моноклинную, а затем при 947 °С-в a-форму. Та2О5 сосуществует с твердым р-ром кислорода в металле Та(О) с содержанием О 1,5 ат. % при 1100 К, 6 ат. % при 1950 К. Содержание кислорода в эвтектике Та2О5-Та(О) близко к 50 ат. %.
При высоких т-рах Та2О5 реагирует с большинством оксидов, образуя сложные оксиды разнообразного состава. Нек-рые из них (с большим содержанием Та2О5) иногда принимались за твердые р-ры на его основе. Nb2O5 и Та2О5 образуют ограниченные твердые р-ры, при высоких т-рах устойчив Та2О5 · 2Nb2O5 (с тетрагон. структурой PNb9O20). Та2О5 не реагирует с Н2, ок. 1830°С взаимод. с С, образуя карбиды и оксикарбиды; с водой и к-тами, кроме фтористоводородной, не реагирует. М. б. переведен в р-римые соед. обработкой фтористоводородной к-той, сплавлением с гидросульфатами, карбонатами, гидроксидами Na и К. В. последнем случае после обработки водой м. б. получен р-р, содержащий ион [Та6О19]8-, из к-рого этанолом осаждается К8Та6О19·16Н2О, к-тами-аморфный Та2О5·xН2О, иногда называемый танталовой к-той, Ta2O5·xH2O получают также гидролизом ТаСl5 или обработкой к-тами продуктов сплавления Та2О5 или танталовых концентратов с карбонатами металлов. Свежеосажденный Та2О5-хН2О легко раств. в р-рах HF, КОН. Т. наз. танталаты (NaTaO3, Na3TaO4, Ca2Ta2O7 и др.) обычно являются сложными оксидами, в к-рых отсутствуют танталат-ионы. Дегидратацией Та2О5·xН2О при 220 °С получают аморфный Та2О5, при 560°С-кристаллич. d-Та2О5.
Та2О5-промежут. продукт в произ-ве Та, танталатов; двойные оксиды Ta(V) и Sr используют как варисторы, Та и Ва- термоэмиссионные материалы (Ва6Та2О11), Та и Ва или Pb-сегнетоэлектрики, Та и Са-катализаторы в орг. синтезе.
Диоксид ТаО2-бесцв. кристаллы с тетрагон. решеткой типа рутила (а = 0,4709 нм, с = 0,3065 нм, z = 2, пространств. группа P42/mnm); метастабилъный промежут. продукт р-ции Та2О5 с ТаСxОу при т-ре ок. 1630 °С и давлении 7,7 ГПа, стабилизируется примесями. При окислении Та (давление О2 10-3-10-6 Па) образуются пленки ТаО и ТаО2 (2-3 монослоя). Ранее были описаны Та6О, Та4О, Та2О, ТаО, однако за эти фазы ошибочно принимались оксикарбиды и оксинитриды, хотя нек-рые из этих тантала оксидов могут образовываться при распаде пересыщенных твердых растворов Та-О. В газовой фазе найдены только молекулы ТаО и ТаО2.
Лит.: Мирошникова Л. Д. [и др.], "Ж. неорган. химии", 1989,. т. 34, № 1, с. 184-87. Л.М.Ковба.
