Тиле-Винтера реакция
ТИЛЕ - ВИНТЕРА РЕАКЦИЯ, ацетоксилирование и одновременное ацетилирование хинонов, сопровождающееся ароматизацией, при действии уксусного ангидрида в присут. кислых катализаторов, напр.:
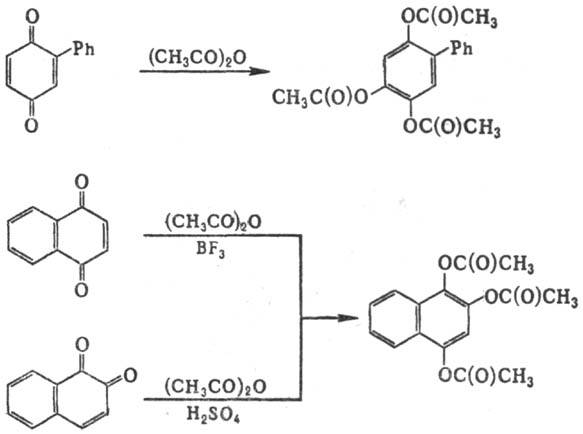
Наиб. активные катализаторы-минер. к-ты (обычно H2SO4, HCl или НСlО4), менее активен BF3 (в смеси с эфиром или СН3СООН). Так, 2,6-диметил-1,4-бензохинон вступает в Тиле - Винтера реакцию в присут. H2SO4, но не реагирует в присут. эфирата BF3.
Монозамещенные 1,4-бензохиноны [заместители: Alk, Аr, Hal, OCH3, С(О)СН3] и 3-замещенные нафтохиноны сравнительно легко вступают в р-цию. Бензохиноны, замещенные в положении 2, ацетоксилируются в положение 5; введение заместителя в положение 2 нафтохинонов препятствует протеканию р-ции.
1,4-Бензохиноны с электроотрицат. заместителями в положениях 2,5 и 2,6 (напр., СН3О или Сl), а также многие 2,3,5-замещенные бензохиноны (напр., 2-бром-3-метокси-5-метил- и 2,3,5-триметилбензохиноны) в Тиле - Винтера реакцию не вступают.
Р-цию обычно проводят при 20-50°С в среде уксусного ангидрида, к к-рому добавляют сначала хинон, затем катализатор; смесь выдерживают при указанной т-ре от неск. часов до неск. суток. Выходы колеблются в пределах от 40-55 до 80%.
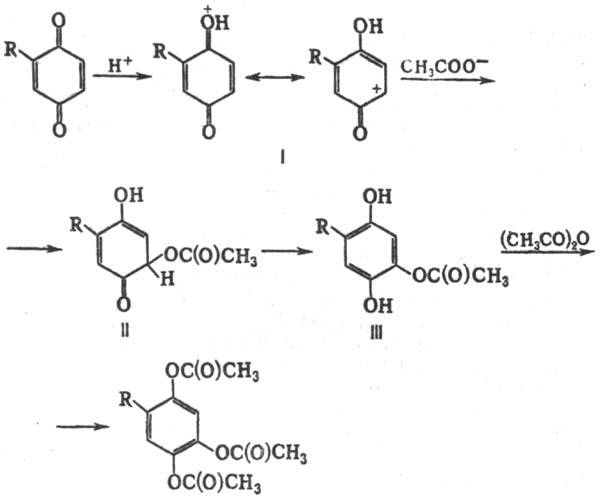
Считают, что Тиле - Винтера реакция начинается с протежирования карбонильной группы хинона с образованием карбкатиона (ф-ла I); последний присоединяет ацетат-ион с образованием промежут. оксосоединения (II), претерпевающего ароматизацию. Образовавшееся производное гидрохинона (III) подвергается далее ацетилированию (не исключено, что ацетилированию подвергается группа ОН промежут. соед. I или II):
Тиле - Винтера реакцию используют в препаративном синтезе для введения кислородсодержащих ф-ций в ароматич. ядро, что применяют, напр., для облегчения выделения нек-рых прир. соединений.
Р.-ция открыта в 1900 И. Тиле и Э. Винтером.
Лит.: McOmie J. F. W., Blatchly J. М., в кн.: Organic reactions, v. 19, N. Y., 1972, р. 199-277. G. И. Дрозд.
