Винилацетилен
ВИНИЛАЦЕТИЛЕН (1-бутен-З-ин) СН2=СНС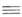 СН, мол. м. 52,076; бесцв. газ с острым запахом; т. пл. — 138°С, т. кип. 5,01 °С; d40 0,7095; nD1 1,4161;
СН, мол. м. 52,076; бесцв. газ с острым запахом; т. пл. — 138°С, т. кип. 5,01 °С; d40 0,7095; nD1 1,4161; Н°исп 23,5 кДж/моль.
Н°исп 23,5 кДж/моль. Нообр - 304,6 кДж/моль; Соp 73,28 Дж/(моль*К); Sо 20,4 Дж/(моль*К). Раств. в бензоле и других орг. р-рителях, не раств. в воде. Атом Н группы —С
Нообр - 304,6 кДж/моль; Соp 73,28 Дж/(моль*К); Sо 20,4 Дж/(моль*К). Раств. в бензоле и других орг. р-рителях, не раств. в воде. Атом Н группы —С СН способен замещаться на металл при взаимод. с металлами или металлорг. соед. типа LiR, RMgHal. С аммиачными р-рами солей Cu(I) или Ag2O винилацетилен также образует металлич. производные, характерные для ацетиленовых углеводородов. При повышенных т-рах и давлении или в присут. инициаторов легко полимеризуется с образованием продуктов, используемых в произ-ве лакокрасочных материалов (см. Винил-и дивинилацетиленовые лаки). Гидрируется над Pd-чернью в мягких условиях до бутадиена. Легко конденсируется с кетонами (р-ция Фаворского):
СН способен замещаться на металл при взаимод. с металлами или металлорг. соед. типа LiR, RMgHal. С аммиачными р-рами солей Cu(I) или Ag2O винилацетилен также образует металлич. производные, характерные для ацетиленовых углеводородов. При повышенных т-рах и давлении или в присут. инициаторов легко полимеризуется с образованием продуктов, используемых в произ-ве лакокрасочных материалов (см. Винил-и дивинилацетиленовые лаки). Гидрируется над Pd-чернью в мягких условиях до бутадиена. Легко конденсируется с кетонами (р-ция Фаворского): 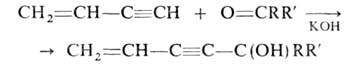
Гидратируется [кат. - соли Hg(II)] с образованием метил-винилкетона СН3СОСН—СН2. Присоединяет галогены по тройной связи и в положение 1,4. Гидрохлорирование винилацетилена в присут. CuCl приводит к хлоропрену СН2=СНС(С1)=СН2.
В пром-сти винилацетилен получают димеризацией ацетилена в водном р-ре, содержащем CuCl, NH4C1 и НС1, при 50-100°С; выход 60-70%; побочный продукт-дивинилацетилен (значит. кол-ва). Винилацетилен может быть получен взаимод. 1,3-дихлор-2-бутена с КОН в среде этиленгликоля. Образуется также как побочный продукт в произ-ве ацетилена электрокрекингом метана. Для винилацетилена КПВ 1,7-73,7%. Раздражает слизистые оболочки; ПДК 20 мг/м3.
Литература
Ньюлэнд Ю., Фогт Р., Химия ацетилена, пер. с англ., М., 1947; Справочник нефтехимика, под ред. С. К. Огородникова, т. 1, Л., 1978. Г. В. Дроздов.
