Хлоропрен
ХЛОРОПРЕН (2-хлор-1,3-бутадиен), СН2 = СС1СН = СН2, мол. м. 88,536; бесцв. летучая подвижная жидкость с характерным эфирным запахом; т. пл. -130,0 °С; т. кип. 59,4 °С;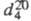 0,9565 г/см3;
0,9565 г/см3;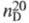 1,4583; ркрит4,26 МПа, tкрит 251,85 °С, dкрит 0,324г/см3;
1,4583; ркрит4,26 МПа, tкрит 251,85 °С, dкрит 0,324г/см3;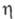 0,408мПа х с (20 °С);
0,408мПа х с (20 °С);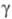 24,1031 мН/м (20°С); давление пара 0,3144 МПа (100 °С); Cр[кДж/(кг х К)] жидкости 1,297 (20 °С), газа 1,0383 (100 °С);
24,1031 мН/м (20°С); давление пара 0,3144 МПа (100 °С); Cр[кДж/(кг х К)] жидкости 1,297 (20 °С), газа 1,0383 (100 °С);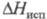 (кДж/кг) 345,81 (0 °С), 314,74 (60 °С);
(кДж/кг) 345,81 (0 °С), 314,74 (60 °С);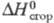 -2222,1 кДж/моль;
-2222,1 кДж/моль;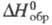 -73,011 кДж/моль;
-73,011 кДж/моль;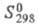 320,58 Дж/(моль х К), коэф. теплопроводности 0,13495 Вт/(м х К) (20 °С): e 4,9. Молекула хлоропрена имеет плоскую трансоидную конфигурацию. Хлоропрен плохо раств. в воде (< 1 % по массе), смешивается с этанолом, бензолом и др. орг. р-рителями.
320,58 Дж/(моль х К), коэф. теплопроводности 0,13495 Вт/(м х К) (20 °С): e 4,9. Молекула хлоропрена имеет плоскую трансоидную конфигурацию. Хлоропрен плохо раств. в воде (< 1 % по массе), смешивается с этанолом, бензолом и др. орг. р-рителями.
Хлоропрен обладает хим. св-вами диеновых углеводородов. Наличие атома С1 и системы сопряженных двойных связей значительно повышает активность хлоропрена в радикальных р-циях и ослабляет в ионных р-циях и диеновом синтезе. Атом С1 химически мало активен. Полимеризация хлоропрена протекает по радикальному механизму легче бутадиена и изопрена. При комнатной т-ре хлоропрен полимеризуется спонтанно с образованием каучукоподобного и губчатого полимеров; образование первого ингибируется фенотиазином, n-трет-бутилпирокатехином, пикриновой к-той, образование второго - NO и N-нитрозодифениламином. Продолжит. хранение в присут. ингибиторов приводит к циклич. димерам; последние перегруппировываются в продукты более сложного состава. Хлоропрен легко автоокисляется с образованием пероксидов, разлагаемых щелочами (ингибиторы - фенолы, гидрохинон, аминофенолы); присоединяет по двойным связям галогены, галогеноводороды и др. обычно в положения 1,4:
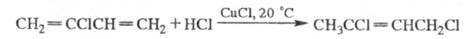
НВrО присоединяется в положения 3,4:

С серой хлоропрен образует 3-хлортиофен, с этиленом (под давлением) - 1-хлор-1-циклогексен, с малеиновым ангидридом -продукт присоединения, к-рый после гидролиза дает 4-хлор-1,2,3,6-тетрагидрофталевую к-ту (т. пл. 173-175 °С). Последняя р-ция может служить для идентификации хлоропрена.
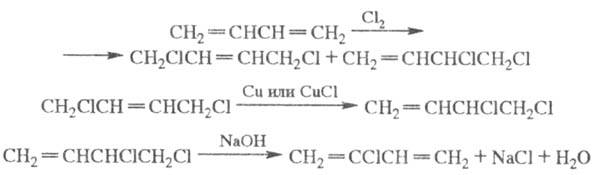
Хлорирование проводят в паровой фазе при 290-330 °С (при строго ограниченном содержании О2 и влаги); конверсия бутадиена обычно 10-25%, выход дихлорбутенов 85-95%, соотношение 3,4-дихлор-1-бутена и 1,4-дихлор-2-бутена (30-40): (60-70); изомеризацию 1,4-дихлор-2-бутена осуществляют в жидкой фазе при 100 °С под вакуумом в присут. Сu и СuС1 или нафтената Сu (с содержанием металлич. Сu ок. 5%); дегидрогалогенирование 3,4-дихлор-1-бутена - водным р-ром 5-15%-ной щелочи при 80-110°С и давлении 0,25 МПа. Выход хлоропрена более 95%, чистота 98,5%.
Получение хлоропрена из ацетилена включает 2 стадии: 1) димеризацию ацетилена в винилацетилен в присут. солянокислого р-ра CuCl и NH4C1 при 65-85 °С и 0,15 МПа (конверсия ацетилена 13-20%, выход винилацетилена на прореагировавший ацетилен 85-90%); 2) гидрохлорирование винилацетилена в присут. CuCl и FеС12 в конц. НС1 при 40-50 °С (конверсия 15-25%, выход хлоропрена на прореагировавший винилацетилен 90-96%, чистота 99,95%).
Хлоропрен- мономер для произ-ва хлоропреновых каучуков.
Пары хлоропрена в небольших концентрациях раздражают слизистую оболочку глаз, при больших концентрациях обладают общетоксич. действием. Длит. действие небольших количеств хлоропрена оказывает мугагенное, эмбриотоксич. и тератогенное действие, увеличивает частоту опухолевых заболеваний.
Хлоропрен- пожаро- и взрывоопасен. Т. всп. -20 °С, т. самовоспл. 421 °С, КПВ в смеси с воздухом 1,2-20% (по объему). ПДК в атм. воздухе 0,002 мг/м3, в воде 0,01 мг/л.
Хлоропрен хранят и транспортируют в жидком виде в охлаждаемых емкостях при т-рах ниже О С в присут. ингибиторов (п-трет-бутилпирокатехин или др.).
Мировое произ-во хлоропрена св. 500 тыс. т в год (1993).
Лит.: Кирпичников П. А., Б ереснев В. В., Попова Л.М., Альбом технологических схем основных производств промышленности синтетического каучука, 2 изд., Л., 1986; Б ашкатов Т. В., Жигалин Я. Л., Технология синтетических каучуков, 2 изд., Л., 1987; Kiik-Othmer encyclopedia, 3 ed., v. 5, N. Y., 1979, p. 773-85; DaubertT.E., Danner R.P., Data compilation tables of properties of pure compounds, pt 2, N. Y., 1985.
Ф. Е. Куперман.
