Рибосомы: элонгация, терминация
После завершения стадии инициации (см. с. 246) к растущей полипептидной цепи присоединяются другие аминокислоты (элонгация) до тех пор, пока рибосома не достигнет стоп-кодона на мРНК и процесс не прекратится (терминация).
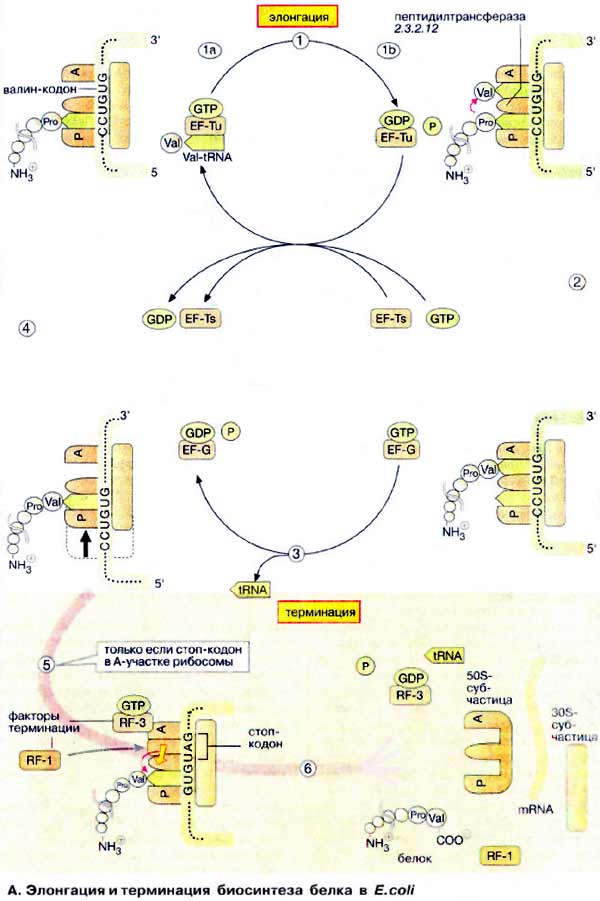
А. Элонгация и терминация биосинтеза белка в E. coli
Элонгацию можно разделить на три стадии. В первой пептидильный участок (P) рибосомы занимает тРНК (tRNA), несущая на 3'-конце растущую пептидную цепь (на схеме вверху слева) Затем вторая тРНК, соединенная с соответствующей аминокислотой (на рисунке показана Val-тPHKVal), взаимодействует своим антикодоном с кодоном мРНК, фиксированным на акцепторном участке (А, в данном случае GUG).
тРНК связывается в виде комплекса с ГТФ-содержащим белком, фактором элонгации Tu (EF-Tu) (1а). Диссоциация комплекса происходит только после того, как связанный ГТФ (GTP) гидролизуется до ГДФ (GDP) и фосфата (1б). До гидролиза ГТФ взаимодействие тРНК с мРНК (mRNA) относительно слабое. Таким образом, гидролиз ГТФ с участием комплекса служит лимитирующим фактором, дающим время для проверки, правильно ли связана тРНК. Затем следующий белок, фактор элонгации Ts (EF-Ts), катализирует обмен ГДФ на ГТФ и таким образом регенерирует комплекс EF-Tu · GTP.
Собственно синтез пептидной связи происходит на следующей стадии (2). Рибосомная «пептидилтрансфераза» катализирует (без потребления АТФ) перенос растущей пептидной цепи от тРНК, находящейся в Р-участке, на аминогруппу валинового остатка, присоединенного к тРНКVаl, связанной на А-участке. Пептидилтрансферазная активность рибосом зависит не от какого-либо рибосомного белка, а, скорее всего, связана с 28S-PHK. Каталитически активные РНК получили название рибозимов. Предполагают, что существующие рибозимы можно рассматривать как реликты «мира РНК», раннего периода биохимической эволюции, когда белки еще не получили такого распространения и не приобрели такого значения, как в последующие периоды.
После переноса растущей цепи в А-участок, свободная аминоацил-тРНК диссоциирует от Р-участка (3) и с рибосомой связывается другой ГТФ-содержащий фактор элонгации (EF-G · GTP). Гидролиз ГТФ этим фактором дает энергию для транслокации рибосомы (3). Во время этого процесса рибосома сдвигает мРНК на три основания в направлении 3'-конца. Поскольку тРНК, несущая полипептидную цепь, не меняет положения относительно мРНК, она попадает в Р-участок рибосомы, в то время как следующий кодон мРНК (в данном случае GUG), попадает в А-участок. Теперь рибосома готова для вступления в следующий цикл элонгации (4).
Когда один из стоп-кодонов (UAG, UAA или UGA) попадает в Α-участок, наступает терминация трансляции (5). Для стоп-кодонов нет соответствующих тРНК. Вместо этого с рибосомой связываются два белковых, высвобождающих фактора (англ. relising factor, RF). Один из них, RF-1, катализирует гидролитическое расщепление эфирной связи между тРНК и С-концом пептида, тем самым высвобождая белок. Энергию для диссоциации комплекса на составляющие компоненты поставляет ГТФ-содержащий фактор RF-3 (6).
Синтез белка требует высоких энергетических затрат. При присоединении одной аминокислоты к растущему полипептиду гидролизуется четыре макроэргические связи. Две молекулы АТФ гидролизуются при активации аминокислоты (см. рис. 239, АТФ → АМФ + неорганический фосфат), и две молекулы ГТФ расходуются во время элонгации. Кроме того, при инициации и терминации на каждую молекулу белка расходуется по одной молекуле ГТФ.
Дополнительная информация
Клетки эукариот содержат больше факторов инициации и вследствие этого имеют более сложную структуру комплекса инициации. Главную роль в инициации играет кэп-структура 5'-конца эукариотической мРНК (см. с. 242), хотя в принципе элонгация и терминация протекают по аналогичной схеме. Отдельные стадии трансляции в бактериях могут ингибироваться антибиотиками (см. с. 250).


