6.9. Солюбилизация
Одним из наиболее характерных свойств мицеллярных растворов ПАВ можно считать их способность растворять нерастворимые в воде вещества. Такое свойство по предложению Мак-Бена получило название «солюбилизация». Поскольку солюбилизация может проявляться не только в водных, но и в неводных растворах, то по определению Мак-Бена, данному им в 1948 г., солюбилизация – это растворение под действием ПАВ нерастворимых в данной жидкости веществ. Процесс солюбилизации можно рассматривать как распределение труднорастворимого вещества между истинным раствором и мицеллами ПАВ. Очевидно, что абсолютно нерастворимые вещества не будут и солюбилизироваться, так как их переход от частиц или капель в мицеллы должен происходить через молекулярный раствор.
Для водных растворов характерна солюбилизация маслоподобных гидрофобных веществ – углеводородов, дисперсных красителей и др. веществ, которые хорошо растворяются в углеводородных жидкостях и трудно растворяются в воде. Для растворов ПАВ в неполярных растворителях характерна солюбилизация воды и водных растворов различных веществ.
Подобные коллоидные растворы аналогичны высокодисперсным эмульсиям прямого (м/в – «масло в воде») и обратного (в/м – «вода в масле») типов. Однако, в отличие от эмульсий, которые представляют собой грубодисперсные системы с четко выраженной поверхностью раздела фаз, обладают избыточной поверхностной свободной энергией и требуют для своего получения затраты работы, мицеллярные растворы ПАВ с солюбилизированным веществом обладают термодинамической устойчивостью, хотя и являются двухфазными системами.
Следует отметить, что такие системы представляют собой классический пример лиофильных коллоидных систем, которые образуются самопроизвольно, избыток свободной поверхностной энергии в которых столь мал, что поверхность раздела фаз не выражена четко и некоторый рост при образовании мицелл компенсируется изменением энтропии системы.
Практические аспекты применения явления солюбилизации необычайно широки. Здесь можно отметить, что в текстильной промышленности это, прежде всего, повышение растворимости дисперсных и кубовых красителей в воде, что необходимо для качественного осуществления процесса колорирования с применением таких красителей. Особенно важно явление солюбилизации в фармакологии, когда ряд лекарственных веществ переводят именно в солюбилизированное состояние.
В 1946 г. А.И. Юрженко установил, что процесс эмульсионной полимеризации в технологии производства полимерных материалов зарождается и протекает именно в мицеллах ПАВ с последующим образованием дисперсии полимера-латекса. Углеводород – мономер - солюбилизируется, и затем уже внутри мицелл протекает процесс полимеризации. Образовавшаяся частичка полимера стабилизируется молекулами или ионами ПАВ и образуется устойчивый латекс синтетического полимера. Такое применение солюбилизации является наиболее широким.
Солюбилизация водонерастворимых веществ происходит и в организме человека и многих животных, что обеспечивает транспорт таких веществ по кровеносной системе между различными частями организма.
1 – С11H23(OC2H4)7OH; 2 – C14H29(OC2H4)6OH; 3 – C10H21(OC2H4)5OH |
Изотермы солюбилизации чаще всего имеют вид, приведенный на рис 2.63. Это - кривая, не проходящая через начало координат, так как солюбилизация возможна только после образования мицелл. Солюбилизацию выражают либо по аналогии с растворимостью как количество вещества в единице объема раствора ПАВ, т.е. моль/л, либо относят к одному молю мицеллярного ПАВ (тогда говорят о молярной солюбилизации, её размерность будет моль солюбилизата/моль ПАВ). Последнее выражение солюбилизации позволяет проследить за мицеллярными переходами, так как солюбилизационная емкость меняется при трансформации формы мицелл, например, от сферической к сфероцилиндру и затем к пластинчатым (ламеллярным) мицеллам.
Для описания изотермы солюбилизации Волков предложил уравнение
S = (n / m) (с-скрит), (2.6.58)
где S- солюбилизация, выраженная, моль/л; n- средняя солюбилизационная емкость мицелл (число солюбилизированных молекул в одной мицелле); m- число агрегации мицелл (среднее число молекул ПАВ в мицелле).
При n/m = const изотерма принимает линейный вид. Если n/m ¹const, то изотерма солюбилизации отклоняется от линейности.
Молярная солюбилизация изменяется скачкообразно при переходе от одной формы мицелл к другой. Типичная зависимость молярной солюбилизации от концентрации раствора ПАВ приведена на рис. 2.64.
|
Отметим, что солюбилизация начинает проявляться только после того, как в растворе ПАВ образуются первые мицеллы. После этого в определенной, подчас узкой, области концентраций молярная солюбилизация растет вследствие того, что в этой области концентраций увеличивается как число мицелл, так и их размер. После завершения формирования сферических мицелл (точка А) молярная солюбилизация остается постоянной вплоть до той концентрации, когда при второй критической концентрации мицеллообразования скрит2сферические мицеллы не начнут перестраиваться в сфероцилиндрические, у которых солюбилизационная емкость выше, чем у сферических мицелл.
После завершения образования таких мицелл (точка В) их солюбилизационная емкость также остается постоянной в некоторой области концентраций до тех пор, пока эти мицеллы не начнут перестраиваться в ламеллярные при третьей критической концентрации мицеллообразования. В слоистых мицеллах нет предела солюбилизации, так как солюбилизированное вещество располагается между слоями ПАВ в области их углеводородных радикалов, где может располагаться неограниченное количество солюбилизата. Таким образом, измерение солюбилизации и выражение в молярных единицах позволяет определять как первую критическую концентрацию мицеллообразования, так и 2-ю и 3-ю ККМ, характеризующие переход от одной формы мицелл к другой.
Величина солюбилизации зависит от химической природы ПАВ - длины углеводородного радикала, замещения атомов водорода в углеводородной цепи другими атомами и группами атомов, характера углеводородного радикала (линейный, разветвленный, содержащий бензольный или нафталиновый циклы и т.д.), природы, положения и числа гидрофильных групп. В первую очередь эти факторы оказывают влияние на размер мицелл - их числа агрегации, объем внутренней углеводородной части или периферийной полярной области мицелл. Чем больший внутренний объем имеет мицелла, тем больше способность данного ПАВ к солюбилизации гидрофобных веществ. Обычно соединения с разветвленной углеводородной цепью обладают значительно большей солюбилизирующей способностью, чем алифатические соединения с эквивалентной длиной цепи.
Введением в растворы ПАВ различных добавок, способных изменить размер мицелл, например, солей (электролитов), низших и высших спиртов и т.д., можно регулировать солюбилизирующую способность. Введением низших спиртов можно произвести даже инверсию фаз, аналогично тому, как это происходит в эмульсиях. За этим превращением можно наблюдать, измеряя, например, электрическую проводимость растворов ионогенных ПАВ.
Повышение температуры обычно способствует солюбилизации, хотя известны случаи более сложного влияния температуры на солюбилизацию, особенно в растворах неионогенных ПАВ.

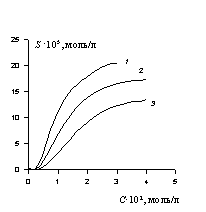 Рис.2.63. Изотерма солюбилизации красителя оранжевого-ОТ растворами неионогенных ПАВ:
Рис.2.63. Изотерма солюбилизации красителя оранжевого-ОТ растворами неионогенных ПАВ: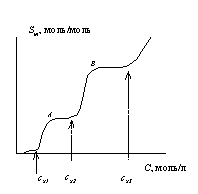 Рис. 2.64. Изотерма молярной солюбилизации (схема)
Рис. 2.64. Изотерма молярной солюбилизации (схема)
