Дифенилацетилeн
ДИФЕНИЛАЦЕТИЛEН (толан)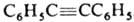 , мол. м. 178,22; бесцв. кристаллы; т. пл. 62,5 °С, т. кип. 300 °С, 170°С/19мм рт. ст., 111-112°С/1 мм рт. ст.; d4100 0,9657; DH0пл 120,1 кДж/кг, DH0обр 319,66 кДж/моль; S0298 245,18 Дж/моль; DG0обр 465,01 кДж/моль; раств. в диэтиловом эфире и горячем этаноле. Длины связей (в нм): 0,119 (
, мол. м. 178,22; бесцв. кристаллы; т. пл. 62,5 °С, т. кип. 300 °С, 170°С/19мм рт. ст., 111-112°С/1 мм рт. ст.; d4100 0,9657; DH0пл 120,1 кДж/кг, DH0обр 319,66 кДж/моль; S0298 245,18 Дж/моль; DG0обр 465,01 кДж/моль; раств. в диэтиловом эфире и горячем этаноле. Длины связей (в нм): 0,119 (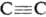 ), 0,140 (С6Н5—С). Дифенилацетилен окисляется хромовым ангидридом в бензойную к-ту, гидрируется до цис-стильбена или дибензила; частичное восстановление тройной связи наблюдается уже при УФ облучении в р-ре метанола. Горячей разб. H2SO4 гидратируется в бензилфенилкетон. Присоединяет галогены, галогеноводороды, нитрозилхлорид, дифенилфосфид Li (в присут. аминов), карбены, диметилсилилен, GeI2 (аддукты часто перегруппировываются в пяти- и шестичленные циклы) и др., вступает в р-цию Дильса-Альдера. При действии на дифенилацетилен Na2S или тиоацетата натрия CH3COSNa, a также тиомочевины (NH2)2CS в системе КОН-ДМСО-Н2О образуется тетрафенилдивинилсульфид, к-рый при нагр. на воздухе количественно окисляется в тетрафенилтиофен. Вступает в фотохим. 1,2-циклоприсоединение с бензохинонами. При взаимод. дифенилацетилена с Li образуется 1,4-дилитийтетрафенил-1,3-бутадиен (ф-ла I), используемый для синтеза гетероциклов, при взаимод. с SеСl4 - 2-фенил-З-хлорбензоселенофен (II).
), 0,140 (С6Н5—С). Дифенилацетилен окисляется хромовым ангидридом в бензойную к-ту, гидрируется до цис-стильбена или дибензила; частичное восстановление тройной связи наблюдается уже при УФ облучении в р-ре метанола. Горячей разб. H2SO4 гидратируется в бензилфенилкетон. Присоединяет галогены, галогеноводороды, нитрозилхлорид, дифенилфосфид Li (в присут. аминов), карбены, диметилсилилен, GeI2 (аддукты часто перегруппировываются в пяти- и шестичленные циклы) и др., вступает в р-цию Дильса-Альдера. При действии на дифенилацетилен Na2S или тиоацетата натрия CH3COSNa, a также тиомочевины (NH2)2CS в системе КОН-ДМСО-Н2О образуется тетрафенилдивинилсульфид, к-рый при нагр. на воздухе количественно окисляется в тетрафенилтиофен. Вступает в фотохим. 1,2-циклоприсоединение с бензохинонами. При взаимод. дифенилацетилена с Li образуется 1,4-дилитийтетрафенил-1,3-бутадиен (ф-ла I), используемый для синтеза гетероциклов, при взаимод. с SеСl4 - 2-фенил-З-хлорбензоселенофен (II). 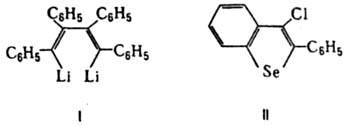
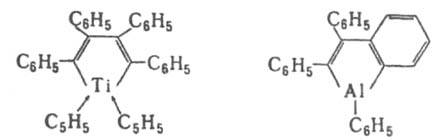
Из дифенилацетилена и TiCl4 (в присут. циклопентадиенилнатрия) или (С6Н5)3Аl (200 °С) получают титан- и алюминийсодержащие соед.:
Синтезируют дифенилацетилен в лаборатории дегидрогалогенированием 1-галоген-1,2-дифенилэтиленов, 1,2-дигалоген-1,2-дифенилэтанов или 1-галоген-2,2-дифенилэтанов (с миграцией фенильного радикала; перегруппировка Фрича - Буттенберга - Вихелля), а также окислением дигидразона бензила желтым HgO. Анализ: по образованию комплекса с 1,3,5-тринитробензолом (т. пл. 96 °С). Лит.. Химия ацетиленовых соединений, под ред. Г. Г. Вийе, пер. с англ., М., 1973; Трофимов Б. А., Амосова С. В., Дивинилсульфид и его производные, Новосиб., 1983. Б. А. Трофимов.
Синонимы/примеры:*
Толан; 1,2-дифенилацетилен
*подобраны ИИ, возможны неточности
Ещё по теме
Дифенилацетилен — характеристики и растворимость
Фенилацетилен — характеристики и применение
1,4-дифенилбензол — свойства и характеристики
Дифениловый эфир — характеристики и применение
Дивинилацетилен — характеристики и применение
Дифенил — характеристики и применение
Дифениловый эфир — характеристики и применение
Дифенилцианарсин — характеристики и история применения
