Транскетолаза
ТРАНСКЕТОЛАЗА (седогептулозо-7-фосфат: D-глицераль-дегид-3-фосфат - гликольальдегидтрансфераза), фермент класса трансфераз, катализирующий обратимую р-цию переноса двухуглеродного фрагмента. (остатка гликоль-адельдегида) с кетоз на альдозы:
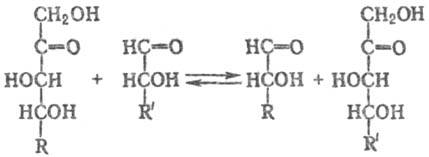
Транскетолаза специфична по отношению к кетозам с транс-положе-нием гидроксильных групп при атомах С-3 и С-4. Обнаружена во всех исследованных тканях животных и растений, а также у микроорганизмов.
Фермент играет важную роль в функционировании пентозофосфатного цикла. Коферменты транскетолазы- тиаминдифос-фат (см. Тиамин) и двухвалентные катионы. Взаимод. субстрата с тиаминдифосфатом осуществляется по атому С-2 тиазольногс кольца.
Наиб. изучена транскетолаза пекарских дрожжей. Фермент представлен двумя изоформами с мол. массами ок. 158-159 тыс. (первичная и пространственная структуры транскетолазы неизвестны). При комнатной т-ре и физиол. значениях рН апофермент (фермент без кофермента) обратимо диссоциирует на две субъединицы с одинаковыми мол. массами. Фермент имеет 2 активных центра с одинаковой каталитич. активностью, к-рая проявляется оптимально при рН 7,6. В состав активного центра входят остатки триптофана, гистидина, аргинина и карбоксильная группа.
Ингибируют фермент ионы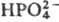 и
и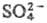 . Реагенты на сульфгидрильную группу влияния на активность не оказывают.
. Реагенты на сульфгидрильную группу влияния на активность не оказывают.
Определение в крови соотношения апо- и холотранскето-лазы (последняя содержит кофермент) используют для характеристики обеспеченности организма тиамином.
Лит.: Кочетов Г. А., Тиаминовые ферменты, М., 1978; Kochetov G.A., в кн.: Methods in enzymology, v. 90, N.Y.-L., 1982, p. 209-23. Г. А. Кочетов.
