Циан
ЦИАН (дициан, динитрил щавелевой к-ты, оксалодинитрил)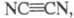 мол. м. 52,035; бесцв. газ с резким запахом. Молекула циана линейна; длина связи С — С 0,1368 нм,
мол. м. 52,035; бесцв. газ с резким запахом. Молекула циана линейна; длина связи С — С 0,1368 нм,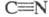 0,1157 нм; т. пл. -27,83 °С, т. кип. -21,15 °С;
0,1157 нм; т. пл. -27,83 °С, т. кип. -21,15 °С;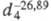 0,9577; давление пара (кПа): 13,3 (-51,5 °С), 73,6 (-27,83 °С); ур-ние температурной зависимости давления пара: lgp(мм рт. ст.) = 9,858 -- 1744,7/Т (177-250 К); ркрит 5,883 МПа (5,82 МПа), tкрит 126,6 °С; для газа:
0,9577; давление пара (кПа): 13,3 (-51,5 °С), 73,6 (-27,83 °С); ур-ние температурной зависимости давления пара: lgp(мм рт. ст.) = 9,858 -- 1744,7/Т (177-250 К); ркрит 5,883 МПа (5,82 МПа), tкрит 126,6 °С; для газа: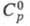 57,08 Дж/(моль x К);
57,08 Дж/(моль x К);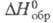 309,1 кДж/моль,
309,1 кДж/моль, -1,096 МДж/моль,
-1,096 МДж/моль,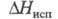 23,33 кДж/моль,
23,33 кДж/моль,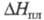 8,108 кДж/моль; у жидкого 22,82 мН/м (-25 °С), 15,82 мН/м (16,25 °С). Ограниченно раств. в воде (0,92% по массе при 20 °С), лучше - в этаноле (7,11% при 20 °С), СН3СООН (15,05% при 20 °С). В водном р-ре постепенно гидролизуется с образованием (NH4OOC)2, HCN, NH3 и СО2. Для циана характерны св-ва псевдогалогенов; подобно, напр., хлору, циан взаимод. с водными р-рами щелочей (CN)2 + 2КОН
8,108 кДж/моль; у жидкого 22,82 мН/м (-25 °С), 15,82 мН/м (16,25 °С). Ограниченно раств. в воде (0,92% по массе при 20 °С), лучше - в этаноле (7,11% при 20 °С), СН3СООН (15,05% при 20 °С). В водном р-ре постепенно гидролизуется с образованием (NH4OOC)2, HCN, NH3 и СО2. Для циана характерны св-ва псевдогалогенов; подобно, напр., хлору, циан взаимод. с водными р-рами щелочей (CN)2 + 2КОН KCN + KCNO + Н2О. С металлами образует комплексные соед., напр. (CN)2 x 2CuCl, с реактивом Гриньяра - нитрилы:
KCN + KCNO + Н2О. С металлами образует комплексные соед., напр. (CN)2 x 2CuCl, с реактивом Гриньяра - нитрилы:
(CN)2 + RMgHal RCN + Mg(CN)Hal
RCN + Mg(CN)Hal
В чистом виде циан устойчив, но в присут. разл. примесей при 300-500 °С превращается в аморфный полимер - парациан (CN)n, где п = 2000-3000, имеющий полициклич. пиразиновую структуру. Парациан м. б. превращен в циан при 800-850 °С в атмосфере N2. При нагр. выше 1000 °С циан диссоциирует на циано-радикалы CN (энергия диссоциации 468,6 кДж/моль), к-рые весьма устойчивы и спектроскопически обнаружены даже в атмосфере Солнца.
Получают циан в крупных масштабах методами, основанными на каталитич. окислении HCN при 200-400 °С О2 воздуха или NO2. В небольших кол-вах циан получают термич. разложением цианидов Ag и Hg либо при действии на цианиды солей Сu:
2KCN + CuSO4 2CuCN + 2K2SO4 + (CN)2
2CuCN + 2K2SO4 + (CN)2
Циан- реагент в орг. синтезе, сырье для получения оксамида и этилендиамина, горючее для газовой резки и сварки металлов (т-ра пламени 4800 К).
Циан горюч; т. самовоспл. 850 °С; КПВ 6-32% (по объему). Ядовит, по токсичности циан несколько уступает HCN и ее солям - цианидам. Обладает раздражающим действием.
Лит.: Бобков С. С, Смирнов С. К., Синильная кислота, М., 1970; Химия псевдогалогенидов, пер. с нем., К., 1981.
С. К. Смирнов.
