Соединения циана. Циан (дициан)
Соединения циана известны с 1704 г., когда была открыта берлинская лазурь. Исследованиями Гей-Люссака (1815) было установлено существование углеродистого «радикала» CN, имеющего сходство с элементарными галоидами. Согласно современным воззрениям, этот одноатомный радикал может иметь двоякое строение:
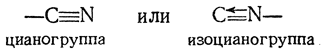
Циан (дициан)
Циан (дициан) был получен Гей-Люссаком при нагревании цианистой ртути:

Этот способ применяется и в настоящее время.
Рекомендован также способ приготовления циана приливанием по каплям водного раствора цианистого калия к раствору медного купороса:
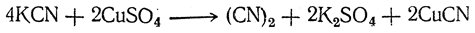
Образование циана здесь аналогично выделению иода при действии иодистого калия на медный купорос.
Спектроскопически обнаружено образование ничтожных количеств циана при накаливании угля в электрической дуге в атмосфере азота.
Циан — бесцветный, очень ядовитый газ с острым запахом, сравнительно легко сгущающийся в жидкость (т. кип. —20,7°С), замерзающую при —34,4° С. Он растворяется в воде и еще легче в спирте, но эти растворы быстро химически изменяются, выделяя хлопья так называемой азульмовой кислоты C4H5N5O; после выпадения азульмовой кислоты в растворе остаются: щавелевокислый аммоний, углекислый аммоний, синильная кислота и мочевина. Циан — соединение эндотермическое (теплота образования 70 кал/моль). Он горит красивым оранжевым пламенем с синей каймой.
Циан — нитрил щавелевой кислоты. Поэтому он может быть получен отнятием воды от амида щавелевой кислоты действием пятиокиси фосфора, и наоборот, присоединяя воду под действием концентрированной соляной кислоты, а также перекиси водорода, он переходит в амид щавелевой кислоты.
Циан реагирует с холодными растворами едкого кали подобно галоидам, причем образуются цианид и цианат калия:
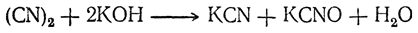
Сернистой кислотой циан восстанавливается в синильную кислоту.
При образовании циана из цианистой ртути, а также при электролизе цианистого калия получается полимер циана — парациан (CN)х, аморфный бурый нерастворимый порошок неизвестного молекулярного веса, при высоких температурах деполимеризующийся в (CN)2.


