Цинка галогениды
ЦИНКА ГАЛОГЕНИДЫ, бесцв. кристаллы тетрагон. сингонии (табл.; см. также Цинка хлорид). Фторид ZnF2 кристаллизуется в структурном типе рутила; при высоких давлениях получены также моноклинная модификация со структурой типа ZrO2, кубич. типа флюорита и ромбич. со структурой типа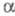 -РbО2; ур-ние температурной зависимости давления пара lgp (мм рт. ст.) = 26,90 - 13650/Т+ 5,03 lg Т (1148 - 1778К); гигроскопичен, мало раств. в воде (1,62% при 20 °С), не раств. в этаноле, разлагается горячими минеральными к-тами. Описан кристаллогидрат с 4 молекулами воды (плотн. 2,567 г/см3), к-рый обезвоживается выше 120 °С. При гидролизе р-ров фторида образуются гидроксофториды, напр. Zn(OH)F. При нагр. на воздухе и в токе водяного пара ZnF2 превращается в ZnO. Получают ZnF2 действием плавиковой к-ты нa ZnCO3 или взаимод. р-ров NaF и ZnSO4 с послед. обезвоживанием. ZnF2 - материал для лазеров, компонент люминофоров, глазурей, эмалей, спец. стекол, р-ров для цинкования, консервант для древесины, протрава при крашении. Токсичен.
-РbО2; ур-ние температурной зависимости давления пара lgp (мм рт. ст.) = 26,90 - 13650/Т+ 5,03 lg Т (1148 - 1778К); гигроскопичен, мало раств. в воде (1,62% при 20 °С), не раств. в этаноле, разлагается горячими минеральными к-тами. Описан кристаллогидрат с 4 молекулами воды (плотн. 2,567 г/см3), к-рый обезвоживается выше 120 °С. При гидролизе р-ров фторида образуются гидроксофториды, напр. Zn(OH)F. При нагр. на воздухе и в токе водяного пара ZnF2 превращается в ZnO. Получают ZnF2 действием плавиковой к-ты нa ZnCO3 или взаимод. р-ров NaF и ZnSO4 с послед. обезвоживанием. ZnF2 - материал для лазеров, компонент люминофоров, глазурей, эмалей, спец. стекол, р-ров для цинкования, консервант для древесины, протрава при крашении. Токсичен.
СВОЙСТВА ГАЛОГЕНИДОВ ЦИНКА
| Показатель | ZnF2 | ZnBr2 | ZnI2 |
| Параметры решетки*, нм: а | 0,47034 | 1,140 | 1,227 |
| с | 0,31335 | 2,180 | 2,354 |
| Число формульных единиц в ячейке | 2 | 32 | 32 |
| Пространств. группа | Р4/тпт | I41/acd | I41/acd |
| Т. пл., °С | 890 | 402 | 446 |
| Т. кип., °С | 1505 | 670 | 111 |
| Плотн., г/см3 | 4,94 | 4,20 | 4,736 |
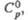 Дж/(моль х К) Дж/(моль х К) | 65,6 | 66 | — |
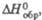 кДж/моль кДж/моль | -764 | -329,7 | -208,2 |
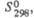 Дж/(моль х К) Дж/(моль х К) | 73,7 | 136 | 161 |
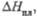 кДж/моль кДж/моль | 41,8 | 15,7 | 17 |
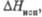 кДж/моль кДж/моль | 185 | 109,6 | 96,2 |
* Тетрагон. сингония.
Бромид ZnBr2 - кроме тетрагон. модификации, известна ромбоэдрич. со структурой типа CdCl2(a = 0,392 нм, с = 1,873 нм, z = 3, пространств. группа R3m). Еще две модификации найдены при высоких давлениях. Может образовывать стекла с плотн. 3,77 г/см3; летуч, возгоняется; хорошо раств. в воде (82,5% по массе при 25 °С, 86,6% при 80 °С). При т-рах от -8 до 35 °С из р-ров кристаллизуется дигидрат ZnBr2 х 2H2O (т. пл. 37 °С), ниже -8 °С - тригидрат, выше 35 °С - безводный бромид. Кристаллогидраты, как и безводный бромид, легко расплываются на воздухе. При гидролизе р-ров бромида образуются гидроксобромиды разл. состава, напр. Zn5(OH)8Br2. Бромид хорошо раств. в этаноле, хуже -в эфире, пиридине и хинолине; в CS2 нерастворим. Получают взаимод. Zn с Вг2 в водном р-ре. Используют как реагент в орг. синтезе, компонент стекол для ИК оптики, конц. р-ры -для наполнения радиационных экранов. Слабо токсичен.
Иодид ZnI2 - очень гигроскопичен; на свету желтеет. Кроме тетрагональной, известны ромбоэдрич. модификация со структурой типа CdCl2(а = 0,425 нм, с = 2,15 нм) и разл. политипы. При нагр. на воздухе превращается в ZnO. Очень хорошо раств. в воде (81,2% при 18 °С, 83,1% при 80 °С), этаноле, хуже - в эфире, ацетоне, глицерине, пиридине; не раств. в CS2. Большим избытком воды гидролизуется. Устойчивая фаза в водных р-рах ниже 0 °С - дигидрат (т. пл. 27 °С), выше 0 °С - безводный иодид. Описан также тетрагидрат, превращающийся при -7 °С в дигидрат. Получают иодид взаимод. Zn с I2 в водном р-ре с послед. выпариванием и высушиванием. Очищают сублимацией. Используют как катализатор в орг. синтезе, аналит. реагент, антисептик в медицине.
Взаимод. Zn с I2 при 1000 °С под давлением получен моноиодид ZnI черного цвета, быстро окисляющийся на воздухе.
П. И. Федоров.
