Природные полипептиды
В природе непрерывно совершается обмен белковых веществ, в ходе которого одни молекулы распадаются, другие образуются вновь. Расщепление белковой молекулы, происходящее в организме под действием так называемых протеолитических ферментов, приводит к образованию сложной смеси полипептидов. Таким образом, полипептиды можно рассматривать как фрагменты молекулы белка.
Число пептидов, выделенных из гидролизатов белков, в настоящее время измеряется сотнями. Во многих случаях была установлена структура выделенных пептидов, некоторые из них, как оказалось, сами по себе обладают интересными биологическими свойствами. Например, L-серил-L-гистидил-L-лейцил-L-валил-L-глутаминовая кислота, выделенная из гидролизата инсулина, специфически ускоряет развитие некоторых бактерий (стрептогениновая активность).
В настоящее время нет экспериментальных данных, доказывающих участие пептидов как промежуточных соединений в синтезе белка. Современные теории биосинтеза белка также не предусматривают участия полипептидов в этом процессе. В то же время установлено, что в различных природных объектах встречаются полипептиды, обладающие, как правило, четко выраженной биологической активностью. Современные методы исследования позволили не только выделить и охарактеризовать большое число природных полипептидов, но и установить их строение. Некоторые из них удалось получить синтетическим путем.
Наиболее подробно изучены полипептиды-антибиотики и полипептиды-гормоны, которые будут рассмотрены ниже.
Окситоцин. Этот гормон, вырабатываемый в задней доле гипофиза, оказывает стимулирующее действие на мускулатуру матки. Строение окситоцина было установлено Дю Виньо.
Для структуры окситоцина характерно наличие цикла (в построении которого участвует дисульфидная группировка) и боковой цепи:
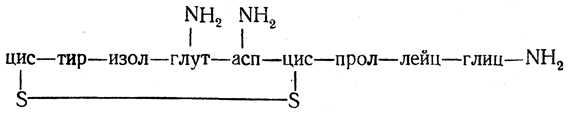
Окситоцин синтезирован несколькими способами и нашел клиническое применение.
Вазопрессин, строение которого имеет много общего со строением окситоцина. также является гормоном задней доли гипофиза. Вазопрессины, выделенные из разных источников, имеют следующее строение:
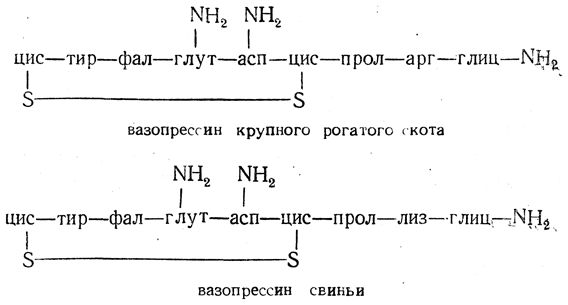
Физиологическое действие вазопрессина иное, чем окситоцина: вазопрессин тонизирует гладкие мышцы и повышает содержание сахара в крови.
Вазопрессин и ряд пептидов, близких по строению к окситоцину и вазопрессину, получены синтетически.
Гипертензин (ангиотонин) — одно из наиболее действенных веществ, повышающих давление крови. При ферментативном расщеплении одного из белков плазмы крови сначала получается не имеющий физиологической активности декапептид гипертензин-I:
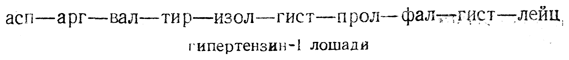
В результате ферментативного расщепления гипертензина-I получается физиологически активный пептид — гипертензин-II:
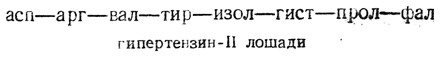
Оба гипертензина получены синтетически.
Глюкагон, состоящий из 29 аминокислотных остатков, образуется в поджелудочной железе и является антагонистом инсулина. Несмотря на значигельную длину пептидной цепи глюкагона, удалось полностью расшифровать его строение (Бромер и сотр.). Оказалось, что это линейный пептид:
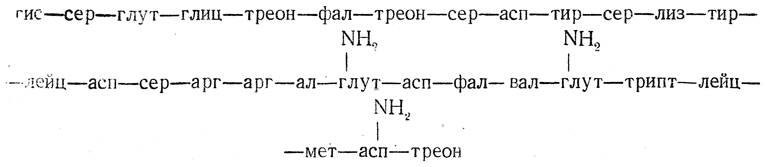
Адренокортикотропный гормон (кортикотропин, АКТГ). Этот гормон, образующийся в передней доле гипофиза, оказывает стимулирующее действие на развитие коркового слоя надпочечников. В настоящее время выделены и изучены адренокортикотропные гормоны нескольких видов животных, причем оказалось, что они имеют сходное строение. Например, АКТГ свиньи представляет собой одну полипептидную цепь, состоящую из 39 аминокислотных остатков:

Показано, что даже после отщепления нескольких аминокислотных остатков адренокортикотропный гормон сохраняет биологическую активность.
Интермедин (меланофоростимулирующий гормон, МСГ) вырабатывается в средней доле гипофиза и специфически воздействует на пигментные клетки животных. Из средней доли гипофиза свиньи удалось выделить два вещества, обладающих активностью меланофоростимулирующего гормона (α- и β-МСГ). Оказалось, что α-МСГ свиньи представляет собой линейную пептидную цепь, построенную из 13 аминокислот:
сер—тир—сер—мет—глут—гист—фал—арг—трипт—глиц—лиз—прол—вал 1 2 3 4 5 6 7 8 9 10 11 12 13
Соответствующие β-гормоны крупного рогатого скота и свиней построены из 18 аминокислот. Значительные участки полипептидных цепей этих гормонов воспроизводят последовательность аминокислот α-МСГ свиньи. Более того, последовательность аминокислот в α-МСГ свиньи в точности соответствует концевому участку адренокортикотропного гормона свиньи (см. аминокислоты 1—13 в АКТГ).


