Тиомочевины диоксид
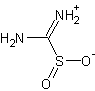
Синонимы:
формамидинсульфинформамидинсульфиновая кислота
Внешний вид:
бел. кристаллыБрутто-формула (система Хилла): CH4N2O2S
Молекулярная масса (в а.е.м.): 108,12
Температура плавления (в °C): 123
Продукты термического разложения:
серы (IV) оксидРастворимость (в г/100 г или характеристика):
ацетонитрил: практически не растворимвода: 3 (20°C)
вода: 4,25 (31°C)
вода: 4,86 (35°C)
диметилсульфоксид: 2,29 (31°C)
диметилсульфоксид: 2,37 (35°C)
диметилсульфоксид: 2,65 (45°C)
диметилформамид: 0,1 (31°C)
диметилформамид: 0,11 (35°C)
диметилформамид: 0,12 (45°C)
нитрометан: практически не растворим
пропиленкарбонат: практически не растворим
тетрагидрофуран: практически не растворим
формамид: 2,18 (31°C)
формамид: 2,25 (35°C)
формамид: 2,65 (45°C)
этанол: 0,75 (20°C)
Вкус, запах, гигроскопичность:
гигроскопиченМетод получения 1.
(лабораторный синтез)Источник информации: Бусев А. И. "Синтез новых органических реагентов для неорганического анализа" М.:Издательство московского университета, 1972 стр. 113
К 230 мл 6%-ной водной перекиси водорода прибавляют постепенно в течение 1 часа 15 г растертой тиомочевины, все время охлаждая реакционную смесь в ледяной ванне. Тиомочевина растворяется. Через 1 ч формамидинсульфин выкристаллизовывается в форме бесцветных игл. Его отфильтровывают и извлекают непрореагировавшую тиомочевину кипящим этанолом, высушивают в вакууме над серной кислотой.
Выход 9 г.
Показатель диссоциации:
pKa (1) = 6,82 (25 C, вода)История:
Впервые получен Барнетом в 1910 г. окислением тиомочевины перекисью водорода.
Дополнительная информация:
Не образует кристаллогидратов. Способен долго хранится.
Восстанавливает альдегиды и кетоны до спиртов с выходом 75-100%. Реагирует с алкиламинами с образованием диоксидов N-алкилтиомочевин. Восстанавливает нитроарены до анилинов в щелочной среде, при большом избытке восстановителя. Восстанавливает сульфоксиды до сульфидов в присутствии иода (без иода реакция не идет) в ацетонитриле при 80 С с выходами более 90%.
- "Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей" 7-е изд. т.2 Л.:Химия 1976 стр. 58
- Буданов В.В., Макаров С.В. "Химия серосодержащих восстановителей (ронгалит, дитионит, диоксид тиомочевины)" М.: Химия, 1994
- Физер Л., Физер М. "Реагенты для органического синтеза" т.7 М.:Мир, 1978 стр. 499
