Реагенты органические
РЕАГЕНТЫ ОРГАНИЧЕСКИЕ в аналитической химии (ОР), орг. соединения разл. классов, служащие для качеств. обнаружения или количеств. определения хим. элементов, функц. групп и соед., а также для разделения, концентрирования, маскирования и др. вспомогат. операций, предшествующих или сопровождающих определение в-в любыми методами.
История. С древнейших времен для обнаружения нек-рых в-в (напр., серебра, железа) применяли прир. в-ва (уксус, отвар чернильных орешков, винный камень, камфора, яичный желток, дубовая кора, хмель и др.). Ряд прир. орг. в-в использовал англ. ученый Р. Бойль. В нач. 19 в. русский химик В. М. Севергин опубликовал труды по аналит. химии, где в качестве ОР описал лакмусовую тинктуру, фиалковый сироп и др. В руководствах И. Берцелиуса, К. Фрезениуса и К. Мора также упоминались разл. природные ОР.
С кон. 19 в. начали применять синтетич. орг. соединения, в частности морин, флуоресцеин, a-нитрозо-b-нафтол, ксан-тогенаты, формальдоксим, 2,2'-дипиридил, 1,10-фенантро-лин, сульфаниловую к-ту (n-аминобензолсульфокислоту) и а-нафтиламин. Р-р последних двух реагентов в разб. СН3СООН наз. реактивом Грисса и до сих пор используется для определения и обнаружения ионов NO2 , с к-рыми он образует азокраситель красного цвета.
С именем Л. А. Чугаева связывают становление в 20 в. нового научного направления - целенаправленного синтеза и применения ОР в аналит. химии. Он впервые сформулировал нек-рые положения теории действия ОР, образующих комплексные соединения. Предложенный ученым в 1905 реагент-диметилглиоксим широко применяют для определения никеля. Вскоре были синтезированы и введены в аналит. практику многие др. реагенты: дифенилкарбазид, куп-ферон, дитизон. Ф. Файгль (1931) развил учение о специфич. функцион. аналит. группировках в ОР.
С 30-х гг. 20 в. ОР становятся основой хим. методов анализа. Синтезируются новые ОР, напр. N-бензоил-N-фе-нилгидроксиламин, 8-гидроксихинолин, арсеназо, торон, интенсивно изучается механизм их действия.
Появление разнообразных физ.-хим. и физ. (электрохим., спектроскопич., ядерно-физ. и др.) методов анализа заметно снизило значение хим. методов вообще и ОР в частности.
Классификация. Разделить ОР на группы можно по разным принципам, напр. по хим. строению (по сходству углеродного скелета или по функц. группам), в зависимости от типа определяемых в-в (катионы металлов, анионы, орг. в-ва), по областям аналит. применения - реагенты для гра-виметрич., титриметрич., фотометрич. или люминесцентного определения элементов, индикаторы, экстрагенты, маскирующие агенты и т.д.
Строение ОР. Аналит. св-ва ОР во многом определяются т.наз. функционально-аналитической атомной группировкой (ФАГ), к-рая представляет собой группу атомов, непосредственно участвующих в аналит. хим. р-ции. ФАГ могут быть, напр., группы ОН, NH2, COOH, SH, AsO(OH)2. Природа ФАГ в большой степени определяет круг компонентов, взаимод. с ОР при данных условиях. Так, согласно т. наз. гипотезе аналогий, с ОР взаимод. те металлы, к-рые склонны образовывать устойчивые соед. с простыми неорг. в-вами, содержащими атомы и группы атомов, к-рые входят в ФАГ молекулы реагента. Напр., элементы, склонные давать устойчивые сульфиды, взаимод. с ОР, содержащими меркаптогруппу, а элементы, склонные давать устойчивые аммиакаты,-с ОР, содержащими аминогруппу, элементы, катионы к-рых склонны к гидролизу,-с ОР, содержащими гидроксигруппу. Это может служить основой для поиска новых ОР.
На аналит. св-ва ОР могут оказывать влияние и др. функц. группы, к-рые иногда называют аналитико-активными. Во мн. случаях механизм аналит. р-ций сложен. Напр., в комп-лексообразовании с ионом металла в зависимости от условий р-ции могут принимать участие разные функц. группы ОР; при координировании иона металла ФАГ может изменять свою структуру; могут образовываться димерные, смешанные и более сложные комплексные соединения. Помимо ФАГ у др. групп на аналит. св-ва ОР влияет строение молекулы ОР в целом (ее углеродный скелет и p-электрон-ная структура).
Для изучения механизма действия ОР получают термоди-намич. и кинетич. характеристики процессов, приводящих к определенному аналит. эффекту (образованию р-римого комплексного соед., осадка и т.д.), выясняют строение ОР и конечного продукта р-ции при разных условиях. При этом используют электрохим. методы, спектрофотометрию, ЭПР, ЯМР, ИК спектроскопию и т.д. Вопрос о строении ОР и продуктов их взаимод., в частности комплексных соед. с элементами,- основа всех теоретич. построений, связанных с объяснением аналит. эффектов данного ОР и с возможностью прогнозировать св-ва новых ОР.
Квантовохим. методы позволяют представить положение электронных энергетич. уровней ОР и его соединений с определяемыми в-вами, предсказать относит. интенсивности полос поглощения в спектрах, а также сделать выводы о строении и характере связей в изучаемых в-вах. Для расчетов наиб. широко применяют метод самосогласованного поля Хартри-Фока-Ругана (с использованием ЭВМ). Установлено, что обычно одна и та же ФАГ удовлетворяет координац. требованиям мн. катионов металлов, к-рые могут с ней взаимодействовать. Методы квантовой химии успешно применяют при исследовании реакц. способности ОР.
Избирательность (селективность). Для характеристики этого св-ва обычно перечисляют хим. элементы (или хим. соед.), к-рые взаимод. с данным ОР при определенных условиях. Чем меньше таких элементов (соед.), тем выше избирательность. При использовании избират. ОР упрощаются методы определения, повышается их экспрессность и надежность. Специфичным называют ОР, взаимодействующий только с одним элементрм (хим. соед.). Таких ОР мало. Избирательность можно повысить, изменяя условия выполнения р-ции или модифицируя структуру самого реагента, т.е. синтезируя аналоги данного ОР. Первый путь сводится к подбору оптим. условий выполнения р-ции, в частности рН среды. Универс. способ повышения избирательности анализа - применение разл. маскирующих в-в, к-рые связывают компоненты, сопутствующие определяемому. Иногда при определении ионов металлов в реакц. систему вводят дополнительно хим. соединение, что приводит к образованию смешанно-лигандного комплексного соед. (т. е. соед., содержащего разл. лиганды), характерного только для определяемого элемента.
Чувствительность. Абс. кол-ва элементов, к-рые м. б. обнаружены при помощи ОР, составляют 10-2-10-4 мкг. Примерами наиб. чувствительных реагентов могут служить дитизон, диметилглиоксим, арсеназо III, тиродин. Применение неводных р-рителей в ряде случаев приводит к существ. повышению чувствительности качеств. анализа.
В спектрофотометрии характеристикой чувствительности является молярный коэф. поглощения е, к-рый для нек-рых комплексных соед. ОР с определяемыми элементами достигает ~106. ОР, добавляемые в анализируемые объекты, в ряде случаев могут в неск. раз повышать чувствительность физ. и физ.-хим. методов (напр., полярографии, атомно-абсорбц. анализа). Предварит. концентрирование (соосажде-нием, экстракцией) позволяют на 1-2, иногда 3-4 порядка понизить пределы обнаружения в-в.
Выбор ОР. Число предложенных ОР для разл. целей непрерывно возрастает и достигло неск. тысяч. Для выбора лучшего ОР сравнивают аналит. данные, характеризующие эффективность применения разных ОР для решения конкретной задачи, т. е. учитывают чувствительность и избирательность реагента, стабильность продукта р-ции, значения рН среды в условиях определения (осаждения, разделения), контрастность в случае цветных р-ций (т. е. изменение длины волны максимума поглощения ОР и продукта его взаимод.), скорость установления равновесия и др. Поскольку число избират. реагентов ограничено, часто для данного компонента (элемента) подбирают неск. ОР (ассортимент). В зависимости от предполагаемого содержания в анализируемом объеме мешающих элементов используют тот или иной ОР из ассортимента или один из ОР применяют для отделения, а другой-для определения исследуемого элемента.
ОР для осаждения веществ. Орг. осадители используются в гравиметрии для определения гл. обр. неорг. ионов. Напр., диметилглиоксим осаждает Pd2+ и Ni2+, 8-гидроксихинолин-А13+, тетрафенилборат натрия-К+ и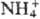 . Получаемые осадки практически не содержат адсорбированных, окклюдированных или др. примесей, легко фильтруются и промываются. После высушивания мн. из них могут служить весовой формой с хорошим фактором пересчета (см. Гравиметрия). Благодаря избирательности ОР и р-ри-мости мн. осадков в орг. р-рителях орг. осадители часто используют для разделения (отделения) элементов. Для выделения элементов из разб. р-ров применяют орг. сооса-дители. Так, в виде комплекса с арсеназо I Am соосаждается с осадком, образованным арсеназо I и кристаллич. фиолетовым.
. Получаемые осадки практически не содержат адсорбированных, окклюдированных или др. примесей, легко фильтруются и промываются. После высушивания мн. из них могут служить весовой формой с хорошим фактором пересчета (см. Гравиметрия). Благодаря избирательности ОР и р-ри-мости мн. осадков в орг. р-рителях орг. осадители часто используют для разделения (отделения) элементов. Для выделения элементов из разб. р-ров применяют орг. сооса-дители. Так, в виде комплекса с арсеназо I Am соосаждается с осадком, образованным арсеназо I и кристаллич. фиолетовым.
Лучшими осадителями (и соосадителями) являются ОР, содержащие гидрофобные заместители (фенильные, алкиль-ные группы), нафталиновые и антрахиноновые ядра.
ОР применяют также для гравиметрич. определения и обнаружения (идентификации) орг. соединений (их функц. групп). Напр., распространенным реагентом на карбонильную группу служит 2,4-дикитрофенилгидразин, образующий с альдегидами и кетонами окрашенные 2,4-дигидрофенил-гидразоны с четкими т-рами плавления; для идентификации аминов получают их производные с такими ОР, как 3-нитро-фенилизоцианат, 3-нитрофталевый ангидрид, 4-нитробен-зоилхлорид, 4-толуолсульфохлорид.
ОР в титрнметрии. Легко получаемые в чистом виде и устойчивые ОР, из к-рых можно приготовить р-ры точно известной концентрации (или быстро установить последнюю простыми методами), применяют в качестве первичных стандартов. Примерами таких ОР могут служить щавелевая, фталевая, янтарная, 4-нитробензойная к-ты, дифенил-гуанидин, N-бромсукцинимид. Р-ры нек-рых ОР пригодны в качестве титрантов. Напр., р-ры аскорбиновой к-ты (в аскорбинометрий) применяют для титрования окислителей-Fе(III), Hg(II), I2, Вг2, 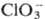 ,
, 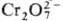 , а также нитро-, нитрозо-, азо- и имйногрупп в орг. соединениях; р-ром N-бромсукцинимида титруют р-ры As(III), Sb(III) и др. восстановителей, а гидрохинон служит титрантом для определения окислителей - Аи (III), Се(IV). Реагент Фишера (р-р I2 и SO2 в смеси пиридина и метанола) широко применяют для определения воды. Наиб. часто в качестве титрантов используют комплексоны, особенно динатриевую соль эти-лендиаминтетрауксусной к-ты (см. Комплексонометрия). Для установления конечной точки титрования часто служат индикаторы, большинство к-рых представляют собой орг соединения.
, а также нитро-, нитрозо-, азо- и имйногрупп в орг. соединениях; р-ром N-бромсукцинимида титруют р-ры As(III), Sb(III) и др. восстановителей, а гидрохинон служит титрантом для определения окислителей - Аи (III), Се(IV). Реагент Фишера (р-р I2 и SO2 в смеси пиридина и метанола) широко применяют для определения воды. Наиб. часто в качестве титрантов используют комплексоны, особенно динатриевую соль эти-лендиаминтетрауксусной к-ты (см. Комплексонометрия). Для установления конечной точки титрования часто служат индикаторы, большинство к-рых представляют собой орг соединения.
ОР для экстракции. Экстракцией можно выделять элементы из очень разб. р-ров. Для этого элемент переводят в гидрофобное соед., напр., с помощью ОР. В нек-рых случаях "активный" экстрагент сам образует экстрагирующееся соед. и сам сольватирует его. В др. случаях экстрагент только растворяет экстрагируемое соед., для образования к-рого необходимо добавить ОР (купферон, 8-гидроксихино-лин). "Активными" экстрагентами м. б. изоамилацетат, ме-тилэтилкетон, циклогексанон, трибутилфосфат, ди(2-этил-гексил) фосфорная к-та, трифенилфосфин и др. Синтезированы ОР для селективной экстракции элементов, напр. экстрагент БТ-1 (5-амино-4-[2-гидрокси-5-хлорфе-нил)азо]-2-(2-гидроксифенил)-2H-бензотриазол) для Са и Sr. В качестве р-рителей для экстракции разл. соединений часто используют СНС13, СС14, С6Н6. Экстрагировать можно и р-римые в воде окрашенные соед. (напр., комплексные соед. мн. металлов с арсеназо III и тороном) в виде ионных ассоциатов. В этих случаях в р-р вводят соль орг. катиона (дифенилгуанидиния, тетрафениларсония и др.) и экстракцию осуществляют полярными р-рителями, напр. бутиловым или амиловым спиртом.
ОР в фотометрическом и люминесцентном анализе. Большинство фотометрич. методов основано на образовании окрашенных комплексных соед. ОР с определяемыми элементами, обычно катионами металлов. При этом неокрашенные ОР (напр., 2,2'-дипиридил, сульфосалициловая к-та для Fe) обьгчно более избирательны, но менее чувствительны, чем окрашенные. В последнем случае для улучшения избирательности строго контролируют рН среды, вводят маскирующие агенты. Примерами окрашенных ОР для фо-тометрич. анализа могут служить арсеназо III, пирокатехм-новый фиолетовый, ксиленоловый оранжевый, фосфоназо, широко применяемые для определения Al, Th, суммы РЗЭ и др.
Элементы, образующие комплексные анионы типа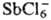 ,
, 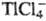
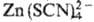 , определяют экстракционно-фотометрич. методом в виде солей с окрашенными орг. катионами. В качестве последних используются метиловый синий, кри-сталлич. фиолетовый, родамин Б и др.
, определяют экстракционно-фотометрич. методом в виде солей с окрашенными орг. катионами. В качестве последних используются метиловый синий, кри-сталлич. фиолетовый, родамин Б и др.
Ионы металлов-окислителей, напр. Аu (III), Се (IV), Cr(VI), Mn(VII), V(V), с нек-рыми бесцв. ОР (напр., бензидином и его производными) образуют окрашенные продукты окисления, оптич. плотность к-рых измеряют. Напр., для определения Cr(VI) широко применяют высокоизбират. р-цию с дифенилкарбазидом, в результате к-рой образуется синий продукт с высоким значением e. Такие окислители, как С12, Се (IV), определяют фотометрически по интенсивности окраски продуктов окисления о-толидина (3,3'-диметилбензи-дин).
Разработаны фотометрич. методы обнаружения и определения соединений с использованием ОР. Напр., аминокислоты определяют с помощью нингидрина, винную к-ту-с помощью 4-диметиламинобензалъдегида, метиловый спирт-с помощью хромотроповой к-ты.
Люминесцентный анализ основан на образовании нек-рыми ОР люминесцирующих комплексных соед. с определяемыми элементами, в частности 8-гидроксихинолина или мори-на с А1, бис-салицилальэтилендиамина с Мn, люмогаллиона [2-гидрокси-5-хлор-3-(2,4-дигидроксифенилазо)бензолсуль-фокислота] с Ga и Nb. Такие ОР, как люминол и люцигенин, используются для хемилюминесцентного определения Со(II), Fe(II), Mn(II), Pb(II) и др. металлов; с помощью люминола определяют также орг. соединения, напр. нафтолы, аминокислоты, аминофенолы.
Прочие случаи применения ОР. Нек-рые орг. в-ва служат компонентами буферных р-ров, напр. бензойная, D-винная, аминоуксусная (глицин), лимонная и фталевая к-ты, мочевина, уротропин.
Мн. ОР, способные образовывать комплексные соед. с катионами металлов, применяют как маскирующие агенты. К ним относятся, в частности, комплексоны, винная, лимонная, сульфосалицшювая, аскорбиновая к-ты, хлорид триэта-ноламмония.
Желатин, поливиниловый спирт служат стабилизаторами разл. суспензий. ОР могут также применяться в качестве активаторов в кинетич. методах анализа, как, напр., пиридин и 2,2'-дипиридил при определении Си и Fe. В полярографии ОР (лимонная к-та, маннит, иодид тетрабутиламмония) вводят в исследуемые р-ры для смещения полярографич. волн.
Иногда используют окислит.-восстановит. св-ва ОР. Напр., тиомочевиной восстанавливают Mo(VI) и Fe(III) в нек-рых методах их определения, ферроценом - Re (VII), Mo(VI), V(V), Ce(IV) и др. элементы при их фотометрич., титриметрич. или амперометрич. определении.
Лит.: Файгль Ф., Капельный анализ органических веществ, пер. с англ., М., 1962; Саввин С. Б., Органические реагенты труппы арсеначо III, М , 1971; Саввин С. Б., Кузин Э.Л., Электронные спектры и структура органических реагентов, М., 1974; Бургер К., Органические реагенты в неорганическом анализе, пер. с англ., М., 1975; Органические реагенты в неорганическом анализе, пер. с чеш., М., 1979; Золотев Ю.А., Кузьмин Н.М., Концентрирование микроэлементов, М., 1982. С. Б. Саввин.
