Нафтолы
НАФТОЛЫ, мол. м. 144,16. 1-Hафтол (a-нафтол, ф-ла I) и 2-нафтол (b-нафтол, II)-бесцв. кристаллы (см. табл.) со слабым фенольным запахом; хорошо раств. в этаноле, диэтиловом эфире, хлороформе, бензоле, плохо-в воде.
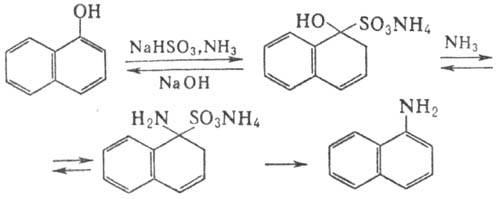
По хим. св-вам - типичные фенолы. С водными р-рами щелочей образуют р-римые в воде соли. С ангидридами и хлорангидридами орг. к-т дают ацетильные производные, со спиртами в присут. НСl или Н2SО4-эфиры, напр. метиловый эфир 2-нафтола ("яра-яра"), т. пл. 72-73 °С, т. кип. 274 °С; эфиры раств. в этаноле, не раств. в воде. При нагр. с NaHSO3 и NH3 нафтолы образуют бисульфитные производные, к-рые с избытком NH3 превращ. в нафтиламины (р-ция Бухерера - Лепти), напр.:
Нафтолы легко вступают в р-ции электроф. замещения. При галогенировании под действием NaClO 1-нафтол образует 2-хлор-1-нафтол, а 2-нафтол -1-хлор-2-нафтол, под действием SO2Cl2 соотв.-4-хлор-1-нафтол и 1,4-дихлор-2-нафтол. При сульфировании 98%-ной H2SO4 1-нафтол превращ. в 1-гидрокси-нафталин-2-сульфокислоту с примесью 4-гидроксинафта-лин-1-сульфокислоты, с 2 молями H2SO4 образует 4-гидро-ксинафталин-1,3-дисульфокислоту. 2-Нафтол при сульфировании при 0°С превращ. сначала в 3-гидроксинафталин-1-сульфо-кислоту, с 10 эквивалентами Н2SО4-в 3-гидроксинафта-лин-1,4-дисульфокислоту; повышение т-ры р-ции приводит к смеси сульфокислот.
При нитровании 1-нафтола 65%-ной HNO3 в СН3СООН нитро-группа вступает в положение 2, в СНСl3-в положения 2 и 4. При нитровании 2-нафтола под действием NO2 нитрогруппа сначала вступает в положение 1, а затем в 6. С диазосоеди-нениями 1-нафтол сочетается по положению 4, а затем 2, 2-нафтол -по положению 1. Гидрирование 1- и 2-нафтолов в кислой среде в присут. Pt (70 °С, 0,3 МПа) приводит соотв. к 5- и 6-ги-дрокситетралинам, в щелочной среде в присут. Ni или Pd/C (60-70°С, 1,2-1,4 МПа)-к 1- и 2-гидрокситетра-линам.
Сухие Na-соли нафтолов подобно фенолятам реагируют с СО2 с образованием гидроксикарбоновых к-т. Так, 1-нафтол при 170°С превращ. в 1-гидроксинафталин-2-карбоновую к-ту, а 2-нафтол при 130°С-в 2-гидроксинафталин-1-карбоновую к-ту; последняя при 200-250 °С перегруппировывается в 3-гидрокси-нафталин-2-карбоновую к-ту.
НЕКОТОРЫЕ СВОЙСТВА НАФТОЛОВ

* Двойное лучепреломление.
1-Нафтол получают гидролизом 1-нафтиламина или 5-амино-нафталин-1-сульфокислоты под действием 20%-ной H2SO4 при 185-240 °С под давлением (выход 69-73%), взаимод. 1-нафтиламина с NaHSO3 и NaOH, сплавлением Na-соли нафталин-1-сульфокислоты с NaOH при 300 °С (выход 93%), а также окислением тетралина О2 или воздухом при 100-130 °С (кат. - МоО2) с послед. дегидрированием в присут. Ni при 200-400 °С.
2-Нафтол получают щелочным плавлением нафталин-2-суль-фокислоты при 300-315 °С (выход 70-82%), окислением 1-изопропил-2-нафтиламина О2 или воздухом при 110°С (кат.-стеарат Na, NaOH или МпО2) с послед. гидролизом, а также гидролизом 2-хлорнафталина водой (кат. - CuO/SiO2, 270-290 °С).
Нафтолы-промежут. продукты в синтезе азокрасителей. 1-Нафтол -исходное в-во для получения 1-гидроксинафталин-2-карбо-новой к-ты, 1-нафтилмочевины (зооцид). 2-Нафтол -исходное в-во в произ-ве 2-гидроксинафталин-3-карбоновой к-ты, 2-гидро-ксинафталинсульфокислот, 2-нафтиламина и 2-фенилнафти-ламина, сильный антисептик, антиоксидант скипидара и каучуков; этиловый эфир 2-нафтола (неролин, или бромелия)-душистое в-во в парфюмерии. Смесь 2-нафтола с тринитро-бензолом, тринитротолуолом и динитрохлорбензолом-фунгицид. Для 2-нафтола т. всп. 153°С, ПДК 0,1 мг/м3.
Лит.: Доналдсон Н., Химия и технология соединений нафталинового ряда, пер. с англ., М., 1963, с. 302-27. Я. Б. Карпова.
