Состав межклеточного матрикса
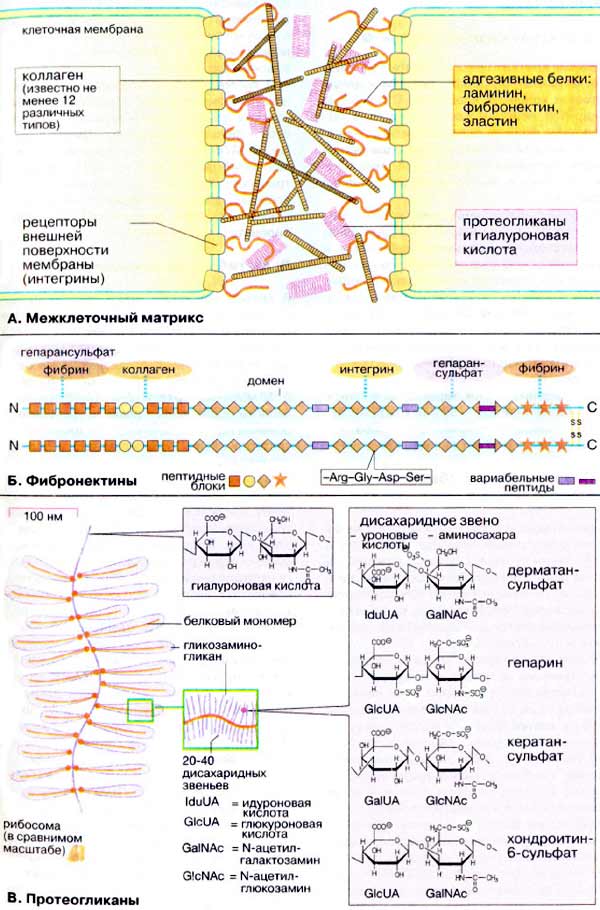
А. Межклеточный матрикс
В интерстициальном внутритканевом пространстве между животными клетками находится сложное межклеточное вещество, экстрацеллюлярный матрикс. У многих тканей, например в мышцах и печени, матрикс заполняет только тонкие промежутки между клетками, тогда как в других тканях, таких, как соединительная, хрящевая и костная ткани, на межклеточный матрикс приходится большой объем и именно он выполняет основные функции. На схеме в упрощенном виде представлены три главных компонента межклеточного матрикса: прочные коллагены, сетчатые адгезивные белки и основное вещество, протеогликаны.
Межклеточный матрикс выполняет разнообразные функции. Он обеспечивает механические контакты между клетками, образует механически прочные структуры, такие, как кости, хрящ, сухожилия и суставы, составляет основу фильтрующих мембран (например, в почках), изолирует клетки и ткани друг от друга (например, обеспечивает скольжение в суставах и движение клеток), формирует пути миграции клеток, вдоль которых они могут перемещаться, например при эмбриональном развитии. Таким образом, межклеточный матрикс чрезвычайно вариабелен как по химическому составу, так и по выполняемым функциям.
Коллагены, которых известно по крайней мере 12 вариантов, образуют нити, фибриллы, сетки и связки. Характерные свойства коллагенов — прочность на разрыв и гибкость. Эластичным белком с аналогичными свойствами является эластин.
Адгезивные белки связывают различные составные компоненты межклеточного матрикса. Наиболее важными представителями являются ламинин и фибронектин. Эти полифункциональные белки характеризуются свойством связывать ряд других компонентов матрикса. Адгезивные белки обеспечивают фиксацию клеток в межклеточном матриксе за счет взаимодействия с мембранными рецепторами.
Протеогликаны выполняют функцию наполнителя (основного вещества). Благодаря полярной природе и сильному отрицательному заряду, они связывают катионы и основную часть воды.
Б. Фибронектины
Типичными представителями адгезивных белков являются фибронектины. Молекулы фибронектинов представляют собой димеры сходных между собой полипептидных цепей (250 кДа), связанных дисульфидными связями. Субъединицы подразделяются на ряд различных доменов способных связываться с клеточными рецепторами, коллагенами, фибрином и протеогликанами. Такая особенность строения фибронектинов придает им свойство «молекулярного клея».
Фибронектины имеют модульную структуру. Они состоят из трех пептидных модулей, которые многократно повторяются (структурные и функциональные домены включают один или насколько таких повторов). Каждый из более чем 50 функциональных блоков кодируется в гене фибронектина одним экзоном. При альтернативном сплайсинге транскриптов РНК гена фибронектина образуются белки различного состава. Модуль, ответственный за связывание фибронектина с клетками, включает характерную аминокислотную последовательность -Arg-Gly-Asp-Ser-. Этот блок обеспечивает связывание фибронектина с клеточными рецепторами, интегринами.
В. Протеогликаны
Протеогликаны — одни из наиболее крупных молекул (М > 2•106 Да); они включают белковую (5%) и углеводную (95%) составляющие и по форме напоминают ершик для мытья бутылок. Белковые мономеры, несущие множество полисахаридных цепей, ассоциированы с осевой молекулой гиалуроновой кислоты (полисахарид, см. с. 48). Полисахариды, обнаруженные в протеогликанах, обычно содержат ацетилированные аминосахара и, следовательно, относятся к гликозаминогликанам.
Основной структурной единицей различных гликозаминогликанов является дисахаридное звено, состоящее из уроновых кислот (глюкуроновой, идуроновой или галактуроновой) и N-ацетилгексозамина (GlcNAc или GalNAc). Протеогликаны составляют основной вещество межклеточного матрикса.


