Коллагены
Коллагены — наиболее распространенные белки в организме животных. Они составляют 25% от общего количества белка. Коллагены образуют нерастворимые нити (фибриллы), которые входят в состав межклеточного матрикса и соединительных тканей.
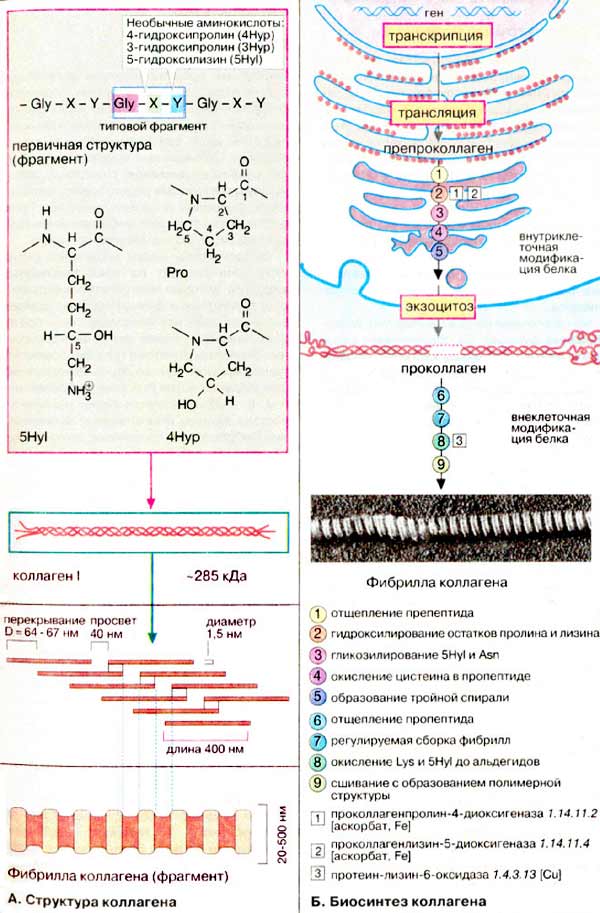
А. Структура коллагенов
Типичная молекула коллагена состоит из трех полипептидных целей разных типов (α-спиралей), скрученных в виде правой тройной спирали. В свою очередь полипептидные цепи построены из часто повторяющихся фрагментов, имеющих характерную последовательность -Gly-X-Y-. Каждым третьим аминокислотным остатком является глицин. Пролин (Pro) часто встречается в положениях X, положение Υ может быть занято как пролином, так и 4-гидроксипролином (4Нур). Кроме того, молекула коллагена содержит остатки З-гидроксипролина (ЗНур) и 5-гидроксилизина (5Нуl). Присутствие в полипептидной цепи остатков гидроксиаминокислот является характерной особенностью коллагена. Остатки пролина и лизина гидроксилируются посттрансляционно, т. е. после включения в полипептидную цепь. На одном из концов молекула коллагена сшита поперечными связями, образованными боковыми цепями остатков лизина. Количество поперечных связей возрастает по мере старения организма.
Известно по крайней мере 12 вариантов коллагена, характеризующихся различным сочетанием полипептидных α-цепей (α1-αЗ и др. подтипы). Наиболее общий тип коллагена I имеет следующую четвертичную структуру: [α1(l)]2α2(l). Это длинная нитевидная молекула с молекулярной массой 285 кДа.
Молекулы коллагенов обладают свойством спонтанно агрегировать с образованием более сложных структур, микрофибрилл и фибрилл. Большинство коллагенов образуют фибриллы цилиндрической формы (диаметром 20- 500 нм) с характерными поперечными полосами, повторяющимися через каждые 64-67 нм.
Б. Биосинтез коллагена
Предшественник коллагена (препропептид) синтезируется на рибосомах на поверхности гранул ШЭР. Прежде чем превратиться в зрелую форму белок-предшественник подвергается значительной посттрансляционной модификации в эндоплазматическом ретикулуме и аппарате Гольджи. Отщепление сигнального пептида (1) приводит к образованию проколлагена. Молекула проколлагена все еще несет на одном конце длинный пропептид. Далее следует гидроксилирование многих остатков пролина и ряда остатков лизина (2). Некоторые остатки гидроксилизина дополнительно гликозилируются (3). Окисление остатков цистеина приводит к образованию внутри- и межмолекулярных дисульфидных связей (4), которые обеспечивают правильное скручивание полипептидных цепей в тройную спираль (5). Прежде чем секретироваться в межклеточное пространство, молекула проколлагена должна пройти стадии модификации и правильной сборки. В процессе транспорта через плазматическую мембрану отщепляются N- и С-концевые пропептиды (6). Коллаген выходит из клетки и в результате ступенчатой сборки образует микрофибриллы (7). Наконец, ε-аминогруппы некоторых остатков лизина подвергаются ферментативному окислению с образованием альдегидных групп (8). Последний этап — конденсация (9) с образованием внутри- и межмолекулярных поперечных связей, в результате чего фибриллы коллагена приобретают окончательную структуру, характеризующуюся прочностью на разрыв и высокой устойчивостъю к действию протеиназ.
В организме коллагены выполняют разнообразные биологические функции. О важной роли коллагенов убедительно свидетельствует множество наследственных генетических дефектов, связанных с мутациями в молекулах коллагенов или ферментов, принимающих участие в их биосинтезе. Такие дефекты могут оказывать влияние на структуру и функцию цитоскелета, связок, сухожилий, кожи, глаз, кровеносных сосудов, волос и даже размеров тела (примером служит синдром Элера-Данлоса).
Гидроксилирование остатков пролина и лизина в молекуле проколлагена катализируется проколлаген-гидроксилазами, имеющими в активном центре атомы железа. В качестве кофермента используется аскорбат (витамин С, см. с. 356). Симптомы дефицита витамина С, такие, как выпадение зубов, кровоточивость десен или повреждения кожи (цинга), объясняются нарушением биосинтеза коллагенов.


