Уроновые кислоты
УРОНОВЫЕ КИСЛОТЫ, моносахариды (альдозы), молекулы к-рых вместо первичной спиртовой группы содержат карбоксильную. Назв. уроновых кислот производят от назв. соответствующих альдоз путем прибавления к корню окончания "уроновая к-та" [напр., D-глюкуроновая к-та (ф-ла I), D-галактуроновая к-та(II)].
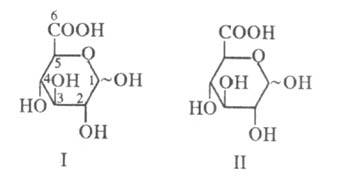
Уроновые кислоты широко распространены в природе. Наиб. часто встречается D-глюкуроновая к-та, найденная в составе мн. растит. гликозидов и полисахаридов (камеди, гемицеллюлозы; в последнем случае вместе с 4-О-метил-О-глюкуроновой к-той). Разл. токсичные в-ва часто выводятся из животных организмов с мочой в виде гликозидов D-глюкуроновой к-ты. D-Галактуроновая к-та известна как главный компонент пектинов высших растений. D-Маннуроновая и L-гулуроновая к-ты -компоненты альгиновых кислот бурых водорослей; L-идуро-новая к-та вместе с D-глюкуроновой входит в состав мукопо-лисахаридов животных тканей. Многие из перечисленных K-T и ряд более редких уроновых кислот, в т. ч. 2-амино- и 2,3-диаминоуро-новые к-ты, обнаружены в составе бактериальных полисаха-ридов.
Уроновые кислоты- кристаллич. или аморфные твердые в-ва; нелетучие, относительно высокоплавки; раств. в воде и сильнополярных орг. р-рителях, не раств. в малополярных р-рителях.
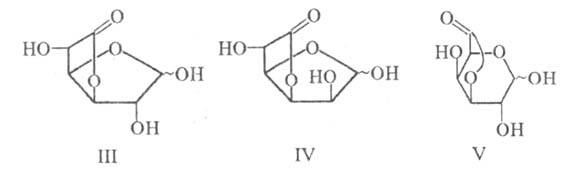
Хим. св-ва уроновых кислот аналогичны св-вам моносахаридов; отличия обусловлены присутствием в молекуле группы COOH, в результате чего уроновые кислоты могут давать соли и лактоны. Легкость лактони-зации и структура лактона определяются природой исходной уроновой кислоты. Так, D-глюкуроновая и D-маннуроновая к-ты самопроизвольно превращаются в 3,6-лактоны (Ш и IV), в к-рых моноса-харид имеет фуранозную форму; D-галактуроновая к-та самопроизвольно не лактонизуется, а получаемый из нее в кислых условиях 3,6-лактон имеет пиранозную форму (V).
При нагр. с сильными минер. к-тами уроновые кислоты претерпевают дегидратацию и декарбоксилирование; образующийся при дегидратации 5-карбоксифурфурол дает цветные р-ции с карбазолом, 3,5-диметилфенолом или 3-гидроксидифенилом, что используют для спектрофотометрич. определения уроновых кислот.
Гликозидные связи, образованные уроновыми кислотами, как правило, приблизительно в 100 раз более устойчивы к действию разб. к-т, чем гликозидные связи, образованные обычными моносаха-ридами. Это позволяет при частичном гидролизе олиго- и полисахаридов, содержащих уроновые кислоты, получать дисахариды с остатком уроновых кислот на невосстанавливающем конце (т. наз. а л ь -добиуроновые к-ты), а из растит. гликозидов, содержащих олигос ах аридную цепь, к-рая начинается остатком D-глюкуроновой к-ты,- т. наз. p r о г е н и н ы, т. е. гликозиды упрощенной структуры, состоящие из агликона и D-глюкуроновой к-ты.
Заместитель в -положении к карбоксильной группе уроновой кислоты (напр., группа ОН или RO) способен отщепляться под действием оснований с образованием
-положении к карбоксильной группе уроновой кислоты (напр., группа ОН или RO) способен отщепляться под действием оснований с образованием  непредельных производных, причем легкость осуществления р-ции сильно зависит от природы уроновой кислоты (производные D-галактуроновой к-ты реагируют много легче производных D-глюкуроновой к-ты) и наличия заряда на карбоксиле (эфиры к-т реагируют много легче, чем их соли).
непредельных производных, причем легкость осуществления р-ции сильно зависит от природы уроновой кислоты (производные D-галактуроновой к-ты реагируют много легче производных D-глюкуроновой к-ты) и наличия заряда на карбоксиле (эфиры к-т реагируют много легче, чем их соли).
Уроновые кислоты получают из прир. источников (напр., D-галактуроно-вую к-ту - гидролизом пектинов в присут. фермента полига-лактуроназы из грибов, D-маннуроновую и L-гулуроновую к-ты - кислотным гидролизом альгинатов) или хим. синтезом, к-рый заключается в действии сильных окислителей (напр., KMnO4) на защищенные производные альдоз, содержащие своб. первичную группу ОН, с последующим удалением защитных группировок.
Лит.: Химия углеводов, M., 1967. А. И. Усов.
