Проламины
ПРОЛАМИНЫ, запасные белки семян злаков (у пшеницы эти белки наз. птиалинами, у кукурузы-зеинами, у ячменя-гордеинами, у ржи-секалинами, у овса-авснинами). Проламины делятся на две группы-серосодержащие (S-богатые) и серо-несодержащие (S-бедные). Все эти белки кодируются семействами родственных генов, имеющих общего предшественника. Часто к проламинам относят также родственные им белки-глютенины (глутелины, или HMW). Все эти группы белков различаются по аминокислотному составу, содержат много остатков глутамина и пролина, мало остатков основных аминокислот (см. табл.).
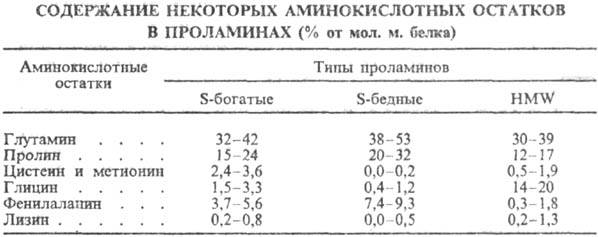
Проламины каждого злака содержат большое кол-во разл. белков и экстрагируются из семян 70%-ным этанолом (это послужило основанием Т. Б. Осборну в 1924 выделить эти белки в самостоят. группу). Мол. м. S-богатых проламинов 20-40 тыс., они содержат внутримол. связи S—S. Мол. м. S-бедных проламинов 45-80 тыс. Глютенины имеют мол. м. 94-145 тыс., с помощью связей S—S они образуют гигантские ассоциаты, к-рые у пшеницы служат основой клейковинного комплекса.
Молекулы S-богатых проламинов и глютенинов имеют четко выраженную доменную организацию и состоят из уникальных и повторяющихся последовательностей аминокислотных остатков. Более древние уникальные последовательности у гордеинов имеют частичную гомологию с белковыми ингибиторами трипсина, а повторяющиеся последовательности у проламинов всех злаков состоят из 7-12 аминокислотных остатков. Типичная повторяющаяся последовательность в глиадинах -Pro—Gin—Gin—Pro—(Х)-(букв. обозначения см. в ст. Аминокислоты, X - остаток одной из кодируемых аминокислот); она варьирует у разных проламинов при сохранении преобладающего числа остатков глутамина и пролина. Кроме того, в молекулы проламинов включены также участки из 4 и более остатков глутамина. Гетерогенность молекул проламинов в осн. обусловлена варьированием числа повторяющихся последовательностей и модификацией в них аминокислотных остатков.
Все предшественники проламинов имеют сигнальный участок, состоящий из 16-20 аминокислотных остатков (первый из них метионин), к-рый обеспечивает проникновение синтезируемой на полисомах (комплекс молекулы матричной РНК с двумя или большим числом рибосом) молекулы проламина через мембрану эндоплазматич. ретикулума; затем этот участок отщепляется.
При электрофорезе в кислой среде на крахмальном или полиакриламидном геле глиадины делятся по подвижности на a-, b-, g- и w-группы, каждая из к-рых включает неск. белков. Гордеины делятся на С и В группы. Причем малоподвижные белки группы В-это S-бедные проламины. Глютенины при обычных условиях электрофореза остаются на старте. При двухмерном электрофорезе глиадинов выделено более 50 компонентов, причем разные сорта пшеницы существенно различаются по составу белков, относящихся к проламинам.
Установлена четкая взаимосвязь между составом электро-форетич. компонентов проламинов и реологич. св-вами теста из муки пшеницы, хлебопекарными достоинствами последней, а также качеством макарон. Самое высокое содержание проламинов (без глютенинов) в суммарном белке пшеницы и ячменя (40-50% по массе), самая низкая (10-15%)-у овса. У этой культуры отсутствуют S-бедные проламины.
Проламины играют исключительно важную роль при хлебопечении и произ-ве макаронных изделий. Предпринимаются попытки с помощью генетич. инженерии модифицировать гены, кодирующие проламины, с целью повышения в них содержания основных аминокислот (напр., лизина), т. к. бедность белков злаков этими аминокислотами сильно снижает их биол. ценность.
Лит.: Конарев В. Г., Белки пшеницы, М., 1983; Созинов А. А., Полиморфизм белков и его значение в генетике и селекции, М., 1985; Kasarda D. D. [а. о.], "Biochem. Biophys. Acta", 1983, v. 747, № 1/2, p. 138-50; Payne P. I. [a.o.], "Theor. Appl. Genet.", 1982, v. 63, № 2, p. 129-38; Кreis M. [a.o.], "Oxford Surveys of Plant Molecular and Cell Biology", 1985, v. 2, p. 253-317. А. А. Созинов.
