Адамантан
АДАМАНТАН (от греч. adamas, род. падеж adamantos-твердый металл; алмаз) (трицикло[3,3,1,13,7]декан), мол. м. 136,23; бесцв. кристаллы с запахом камфоры; т.пл. 269°С; легко возгоняется; d204 1,07;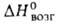 58,6 кДж/моль,
58,6 кДж/моль,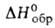 —197,2 кДж/молъ; раств. в орг. р-рителях, не раств. в 50%-ном спиоте и воде. Углеводный скелет адамантана подобен структурной единице алмаза. Жесткая, но не напряженная молекула, включающая три конденсированных циклогексановых кольца в конфор-мации кресла, обладает высокой симметрией (группа Td). При 20 °С адамантан имеет беспорядочную гранецентриров. кубич. структуру, переходящую при — 65°С в тетрагональную. Все длины связей С-С равны 0,154 нм, валентные углы 109,5°.
—197,2 кДж/молъ; раств. в орг. р-рителях, не раств. в 50%-ном спиоте и воде. Углеводный скелет адамантана подобен структурной единице алмаза. Жесткая, но не напряженная молекула, включающая три конденсированных циклогексановых кольца в конфор-мации кресла, обладает высокой симметрией (группа Td). При 20 °С адамантан имеет беспорядочную гранецентриров. кубич. структуру, переходящую при — 65°С в тетрагональную. Все длины связей С-С равны 0,154 нм, валентные углы 109,5°.
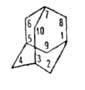
Уникальное, максимально приближенное к сферическому строение адамантана обусловливает особенности его св-в. Подобно алмазу, адамантан исключительно термостабилен (до 660 °С). Узловые атомы С (положения 1, 3, 5, 7) в адамантане и его производных более реакционноспособны, чем в др. мости-ковых углеводородах. Адамантан легко бромируется жидким Вr2 до 1-бромадамантана.
Адамантан найден в нефтях нек-рых месторождений в концентрации 0,0004-0,0013% по массе.
Получают адамантан гидрированием дициклопентадиена до эндотриметиленнорборнана (трицикло[5,2,1,02,6]декана) с послед. его изомеризацией (кат.-АlВr3, АlСl3):
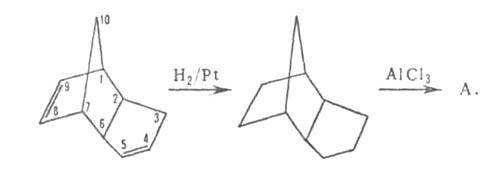
Выход 50%. Изомеризация др. полициклич. пергидроароматич. углеводородов (напр., пергидроаценафтена, пергидроантрацена, пергидрофенантрена) приводит к алкилпроизводным адамантана; выход до 90%.
Содержащие адамантан полимеры обладают высокими т-рами стеклования и размягчения, низкой усадкой, прозрачностью и применяются в произ-ве оптич. стекол. Высоковязкие р-ры полиадамантилакрилатов - загустители смазочных масел. Производные адамантана - лек. в-ва (амантадин, ремантадин, троматадин).
Адамантан впервые синтезирован В. Прелогом в 1941.
Литература
Севостьянова В. В., Краюшкин М. М., Юрченко А. Г., "Успехи химии", 1970, т. 39, в. 10, а 1721-53; Хардин А. П.. Радченко С. С, там же. 1982, т. 51, в. 3, с. 480-506; Багрий Е.Н., Сагинаев А.Т., там же, 1983, г. 52, в. 9, с. 1538-67; Fort R. С, Adamantane. The chemistry of diamond molecules, N.Y., 1976. Д.В. Иоффе. Р. Я. Попова.
