Определение молекулярного веса органических веществ
Данные количественного элементарного анализа позволяют вычислить только одну из кратных формул вещества, соответствующих данному составу. Так, например, если найдено, что органическое вещество содержит 54,54% С, 9,09% Н и 36,37% О, то его простейшая формула будет С2Н4О. Такая формула соответствует, в частности, уксусному альдегиду. Однако найденный процентный состав имеет не только ацетальдегид, но и аль-доль (С4Н8О2), паральдегид (C6H12O3) и метальдегид (C8H16O4). Эти вещества имеют соответственно удвоенный, утроенный и учетверенный молекулярный вес сравнительно с ацетальдеги-дом. Очевидно, что для установления истинной эмпирической формулы вещества необходимо знать его молекулярный вес.
Многочисленные методы определения молекулярного веса разделяются на две группы: 1) определение молекулярного веса вещества, находящегося в газообразном состоянии, и 2) определение молекулярного веса вещества, находящегося в растворенном виде.
Наиболее распространенный метод первой группы (метод В, Мейера) заключается в том, что взвешенную пробу вещества быстро испаряют в предварительно нагретом сосуде. Вследствие испарения вещества из сосуд-а вытесняется определенное количество воздуха, который собирают над водой в градуированный газометр. По объему вытесненного воздуха судят об объеме паров исследуемого вещества, а зная навеску вещества и его объем в газообразном состоянии, вычисляют плотность парообразного вещества с помощью соответствующих таблиц по формуле
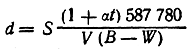
где S— навеска;
t — температура, при которой производилось измерение
объема воздуха; V — измеренный объем воздуха; В — барометрическое давление, приведенное к 0°С; W—давление водяного пара при температуре t.
Определив плотность пара, вычисляют молекулярный вес вещества по известной формуле М = 2d.
Подобными методами можно определять молекулярный вес только таких веществ, которые могут переходить в пары без разложения. Однако значительное число органических веществ имеет слишком высокие температуры кипения или даже разлагается ниже температуры кипения. Поэтому химика-органика больше интересуют методы определения молекулярного веса вещества в растворенном виде, основанные на законах осмотического давления. Непосредственное определение осмотического давления очень сложно; поэтому обычно измеряют следующие величины, зависящие от осмотического давления: повышение температуры кипения или понижение температуры замерзания растворов (депрессию температуры плавления смесей).
При оценке полученных данных нужно иметь в виду, что при различных концентрациях раствора вследствие возможной ассоциации растворенного вещества могут получаться различные значения измеряемых величин. Вещества, содержащие гидр-оксильную группу, например спирты, в большинстве случаев склонны к ассоциации в растворителях, не содержащих гидр-оксильной группы. Кроме того, правильно определить понижение температуры замерзания можно только в том случае, если вымерзает чистый растворитель, что наблюдается не всегда. Само собой разумеется, что для диссоциирующих веществ нельзя употреблять растворители, вызывающие диссоциацию, так как определяемый молекулярный вес окажется ниже его действительного значения.
При определении молекулярного веса вещества как по повышению температуры кипения (эбулиоскопический метод), так и по понижению температуры замерзания (криоскопический метод) необходимо применять особо чувствительный термометр — термометр Бекмана, позволяющий производить отсчеты температуры с точностью не меньшей, чем 0,005 °С.
Вычисление молекулярных весов М в обоих методах производят по общей формуле
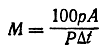
где р — навеска исследуемого вещества;
А — так называемое молярное понижение температуры замерзания (молярная, или молекулярная, депрессия) или молярное повышение температуры кипения, т. е. такое понижение температуры замерзания или повышение температуры кипения, которое наблюдается при растворении одного моля вещества в 1000 грастворителя;
P — вес растворителя;
Δt — наблюдаемое понижение температуры замерзания или повышение температуры кипения.
Ниже приводятся значения А для наиболее часто применяемых растворителей.

Весьма удобен метод определения молекулярного веса по депрессии температуры плавления камфоры (Раст), представляющий собой по существу видоизменение криоскопического метода. В связи с тем, что камфора обладает довольно высокой температурой плавления (172°С) и необычайно большой моляр ной депрессией (— 40 °С), этим методом можно с удовлетворительной точностью определять молекулярные веса очень многих веществ. Для проведения определения достаточно нескольких миллиграммов веществ; отсчет температуры производится с помощью обычного термометра с точностью до 0,5 °С.
Следует иметь в виду, что величина А для камфоры постоянна при добавлении более 0,2 моль исследуемого вещества на 1 кг камфоры. С уменьшением содержания добавки величина А постепенно возрастает до 50 °С.
Располагая данными полного количественного элементарного анализа вещества и зная его молекулярный вес, можно легко установить истинную эмпирическую формулу соединения.


