Железа пентакарбонил
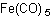
Внешний вид:
светло-желт. жидкость Кристаллические модификации, цвет растворов и паров:
При охлаждении до -196 С кристаллы обесцвечиваются.Брутто-формула (система Хилла): C5FeO5
Формула в виде текста: Fe(CO)5
Молекулярная масса (в а.е.м.): 195,9
Температура плавления (в °C): -21
Температура кипения (в °C): 105
Температура разложения (в °C): 130
Растворимость (в г/100 г или характеристика):
ацетон: растворимбензин: растворим
бензол: растворим
вода: не растворим
диэтиловый эфир: растворим
этанол: растворим
Способы получения:
1. Получают реакцией порошка железа с оксидом углерода (II) при 150-200 С и давлении 100 ат.Плотность:
1,453 (20°C, г/см3)1,53 (-20°C, г/см3)
1,493 (0°C, г/см3)
1,474 (13,4°C, г/см3)
1,47 (15,5°C, г/см3)
1,468 (16,5°C, г/см3)
1,462 (19°C, г/см3)
1,456 (21,1°C, г/см3)
1,46 (22°C, г/см3)
1,421 (40°C, г/см3)
1,382 (60°C, г/см3)
Давление паров (в мм.рт.ст.):
10 (4,7°C)28 (18°C)
100 (50,3°C)
Диэлектрическая проницаемость:
2,6 (20°C)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-764 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-695,2 (ж)Стандартная энтропия образования S (298 К, Дж/моль·K):
338 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
240,6 (ж)Летальная доза (ЛД50, в мг/кг):
1,75 (кролики, перорально)1,75 (кролики, внутривенно)
Симптомы острого отравления:
Сильно ядовит при вдыхании, введении внутрь или всасывании через неповрежденную кожу. Вызывает острый отек легких независимо от пути введения. Предполагают, что выделение происходит через легкие. В условиях производства отравления протекали сходно с картиной интоксикации угарным газом.
Применение:
Для получения карбонильного железа (используемого например в порошковых муфтах сцепления), чистого оксида железа (III).
Дополнительная информация:
Строение молекулы - тригональная бипирамида. Диамагнитен. Поенциал ионизации 8,53 в.
Горит на воздухе с образованием чистого оксида железа (III), использующегося при производстве магнитофонных лент и полировочного материала. Реагирует с тетрахлорметаном с образованием хлорида железа (II), гексахлорэтана и угарного газа. В эфирном растворе реагирует с серной кислотой с образованием сульфата железа (II), угарного газа и водорода. При действии щелочей в вакууме образуется тетракарбонилдигидрид железа. С жидким аммиаком при 20 С (под давлением) дает мочевину и тетракарбонилферрат аммония. В аммиачном растворе реагирует с натрием с образованием тетракарбонилферрата натрия. Гидролизуется водой.
При хранении на свету отщепляет часть угарного газа и образует нонакарбонил дижелеза.
- "Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей" 7-е изд. т.3 Л.:Химия 1976 стр. 529
- Волков В.Л., Сыркин В.Г., Толмасский И.С. "Карбонильное железо" М.: Металлургия, 1969 стр. 27
- Некрасов Б.В. "Основы общей химии" т.2 М.:Химия, 1973 стр. 345-346
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 63
