Метаболизм жиров
А. Метаболизм жиров: общие сведения.
Метаболизм жиров в жировой ткани (на схеме сверху)
Жиры (триацилглицерины) — наиболее важный резерв энергии в организме животных. Они хранятся главным образом в клетках жировой ткани, адипоцитах. Там же они участвуют в постоянно происходящих процессах образования и деградации.
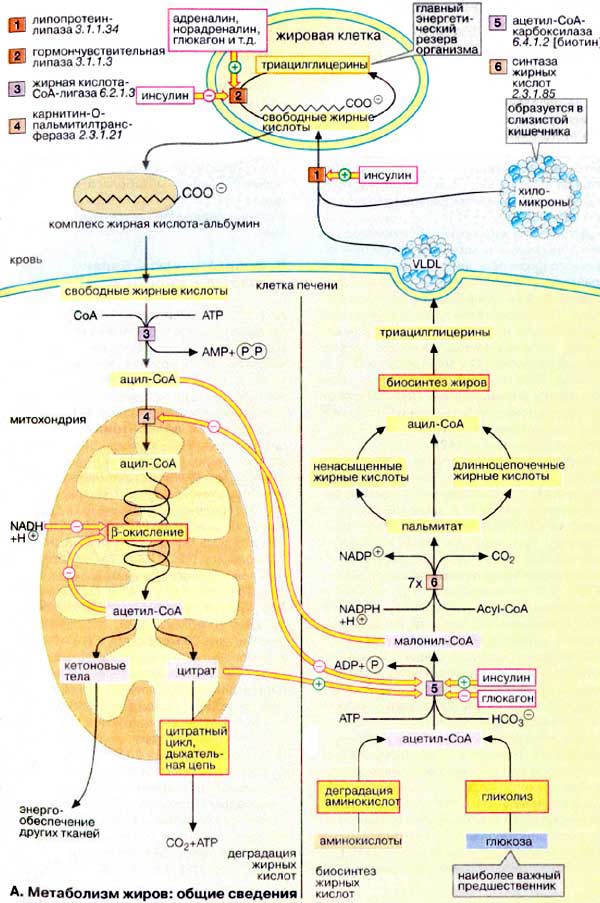
Жирные кислоты, необходимые для синтеза жиров (липогенеза), в составе триацилглицеринов переносятся из печени и кишечника в виде липопротеиновых комплексов (ЛОНП и хиломикроны). Липопротеин-липаза [1], находящаяся на поверхности эндотелиальных клеток кровеносных капилляров, отщепляет от этих липопротеинов жирные кислоты.
В адипоцитах деградация жиров (липолиз) катализируется гормонзависимой липазой [2]. Уровень свободных жирных кислот, поступающих из жировой ткани, зависит от активности этой липазы — фермент регулирует таким образом уровень жирных кислот в плазме.
Жирные кислоты из жировой ткани транспортируются в плазму крови в неэтерифицированной форме. При этом растворимы только короткоцепочечные жирные кислоты, а жирные кислоты с более длинными цепями, менее растворимые в воде, переносятся в комплексе с альбумином.
Деградация жирных кислот в печени (на схеме слева)
Жирные кислоты поступают из плазмы крови в ткани; здесь из них синтезируются жиры или за счет окисления получается энергия. Особенно интенсивен метаболизм жирных кислот в клетках печени (гепатоцитах).
Наиболее сажным процессом деградации жирных кислот является β-окисление в митохондриях. При этом жирные кислоты вначале активируются в цитоплазме, присоединяясь к коферменту А [3]. Затем они с помощью транспортной системы (карнитинового челнока [4]; см. рис. 215) попадают в митохондриальный матрикс, где разрушаются в результате β-окисления до ацетил-КоА. Образующиеся ацетильные остатки полностью окисляются до СО2 в цитратном цикле с освобождением энергии в виде АТФ (АТР). Если количество образовавшегося ацетил-КоА превосходит энергетическую потребность гепатоцитов, что наблюдается при высоком содержании жирных кислот в плазме крови (типичные случаи — голодание и сахарный диабет), то в гепатоцитах синтезируются кетоновые тела, снабжающие энергией уже другие ткани.
Синтез жирных кислот в печени (на схеме справа)
Биосинтез жирных кислот протекает в цитоплазме, в основном в печени, жировой ткани, почках, легких и молочных железах. Главным источником атомов углерода является глюкоза, однако возможны и другие предшественники ацетил-КоА, например аминокислоты.
Первая стадия — карбоксилирование ацетил-КоА с образованием малонил-СоА — катализируется ацетил-КоА-карбоксилазой [5], ключевым ферментом биосинтеза жирных кислот. Создание длинноцепочечных жирных кислот осуществляется синтазой жирных кислот [6]. Исходя из молекулы ацетил-КоА под действием этого полифункционального фермента, цепь удлиняется (процесс включает семь реакций) путем добавления малонильных групп и отщепления СО2 (в каждой реакции) с образованием пальмитата. Таким образом, в результате каждой реакции молекула удлиняется на два углеродных атома. В качестве восстановителя используется НАДФН + Н+, образующийся в гексозомонофосфатном пути или в реакциях, катализируемых изоцитратдегидрогеназой и «малатферментом».
Удлинение цепи жирной кислоты на синтазе жирных кислот заканчивается на C16, т.е. на пальмитиновой кислоте (16:0). В последующих реакциях пальмитат используется в качестве предшественника для получения ненасыщенных или более длинноцепочечных жирных кислот.
Дальнейший биосинтез жиров протекает с участием активированных жирных кислот (ацил-КоА) и 3-глицерофосфата. Для обеспечения других тканей жиры в гепацитах упаковываются в липопротеиновые комплексы типа ЛОНП (VLDL) и поступают в кровь (см. рис. 273).


