Механизм действия гидрофильных гормонов
А. Механизм действия гидрофильных гормонов
Большинство гидрофильных сигнальных веществ не способны проходить через липофильную клеточную мембрану. Поэтому передача сигнала в клетку осуществляется через мембранные рецепторы (проводники сигнала). Рецепторы — это интегральные мембранные белки, которые связывают сигнальные вещества на внешней стороне мембраны и за счет изменения пространственной структуры генерируют новый сигнал на внутренней стороне мембраны. Данным сигналом определяется транскрипция определенных генов и активность ферментов, которые контролируют обмен веществ и взаимодействуют с цитоскелетом.
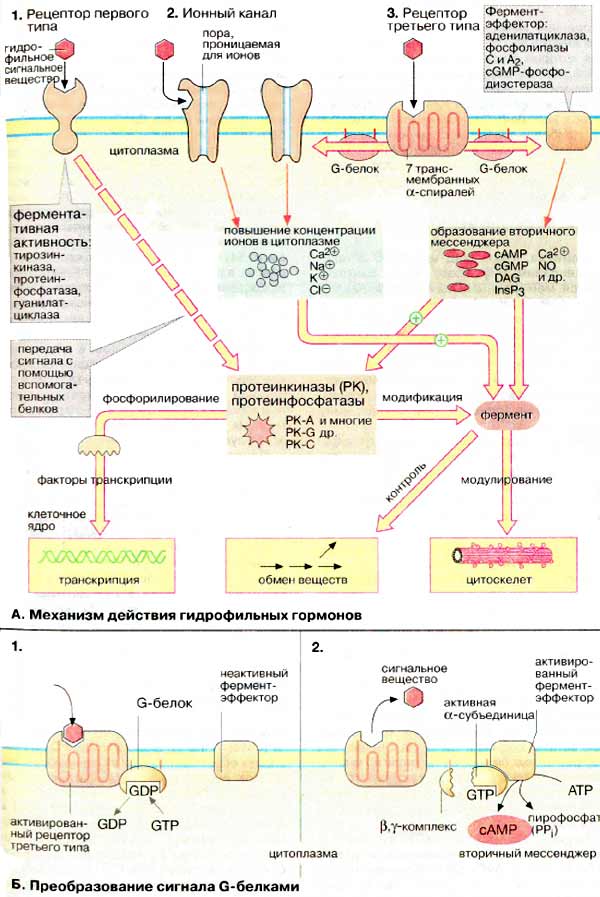
Различают три типа рецепторов.
1. Рецепторы первого типа являются белками, имеющими одну трансмембранную полипептидную цепь. Это аллостерические ферменты, активный центр которых расположен на внутренней стороне мембраны. Многие из них являются тирозиновыми протеинкиназами. К этому типу принадлежат рецепторы инсулина, ростовых факторов и цитокинов.
Связывание сигнального вещества ведет к димеризации рецептора. При этом происходит активация фермента и фосфорилирование остатков тирозина в ряде белков. В первую очередь фосфорилируется молекула рецептора (автофосфорилирование). С фосфотирозином связывается SН2-домен белка-переносчика сигнала, функция которого состоит в передаче сигнала внутриклеточным протеинкиназам.
2. Ионные каналы. Эти рецепторы второго типа являются олигомерными мембранными белками, образующими лиганд-активируемый ионный канал. Связывание лиганда ведет к открыванию канала для ионов Na+, К+ или Cl-. По такому механизму осуществляется действие нейромедиаторов, таких, как ацетилхолин (никотиновые рецепторы: Na+- и К+-каналы) и γ-аминомасляная кислота (А-рецептор: Cl--канал).
3. Рецепторы третьего типа, сопряженные с ГТФ- связывающими белками. Полипептидная цепь этих белков включает семь трансмембранных тяжей. Такие рецепторы передают сигнал с помощью ГТФ-связывающих белков на белки-эффекторы, которые являются сопряженными ферментами или ионными каналами. Функция этих белков заключается в изменении концентрации ионов или вторичных мессенджеров. Таким образом, связывание сигнального вещества с мембранным рецептором влечет за собой один из трех вариантов внутриклеточного ответа: рецепторные тирозинкиназы активируют внутриклеточные протеинкиназы, активация лиганд-активируемых ионных каналов ведет к изменению концентрации ионов и активация рецепторов, сопряженных с ГТФ-связывающими белками, индуцирует синтез веществ-посредников, вторичных мессенджеров. Все три системы передачи сигнала взаимосвязаны. Так, например, образование вторичного мессенджера цАМФ (сАМР) приводит к активации протеинкиназ А [ПК-А (PK-A)], вторичный мессенджер диацилглицерин [ДАГ (DAG)] активирует [ПК-С (PK-C)], а вторичный мессенджер инозит-1,4,5-трифосфат [ИФ3 (InsP3)] вызывает повышение концентрации ионов Са2+ в цитоплазме клетки.
Б. Преобразование сигнала G-белками*
G-белки переносят сигнал с рецептора третьего типа на белки-эффекторы. Они построены из трех субъединиц: α, β и γ. α-cубъединица обладает свойством связывать гуаниновые нуклеотиды [ГТФ (GTP) или ГДФ (GDP)]. Белок проявляет слабую ГТФ-азную активность и похож на другие ГТФ-связывающие белки, такие, как ras и фактор элонгации Tu (EF-Tu). В неактивном состоянии G-белок связан с ГДФ.
При связывании сигнального вещества с рецептором третьего типа конформация последнего изменяется таким образом, что комплекс приобретает способность связывать G-белок. Ассоциация G-белка с рецептором приводит к обмену ГДФ на ГТФ (1). При этом происходит активация G-белка, он отделяется от рецептора и диссоциирует на α-субъединицу и β,γ-комплекс. ΓΤΦ-α субъединица связывается с белками-эффекторами и изменяет их активность, в результате чего происходит открывание или закрывание ионных каналов, активация или ингибирование ферментов (2). Медленный гидролиз связанного ГТФ до ГДФ переводит α-субъединицу в неактивное состояние и она вновь ассоциирует с β,γ-комплексом, т.е. G-белок возвращается в исходное состояние.
___________________
*В отечественной литературе G-белки иногда называют N-белками (см. Овчинников Ю. А. "Биоорганическая химия", 1987, М., Просвещение, сс. 240-242). — Прим. перев.


