Вторичные мессенджеры
Вторичные мессенджеры, или посредники, это внутриклеточные вещества, концентрация которых строго контролируется гормонами, нейромедиаторами и другими внеклеточными сигналами. Такие вещества образуются из доступных субстратов и имеют короткий биохимический полупериод. Наиболее важными вторичными мессенджерами являются цАМФ (сAMP), цГМФ (cGTP), Са2+, инозит-1,4,5-трифосфат [ИФ3 (lnsP3)], диацилглицерин [ДАГ (DAG)] и монооксид азота (NO).
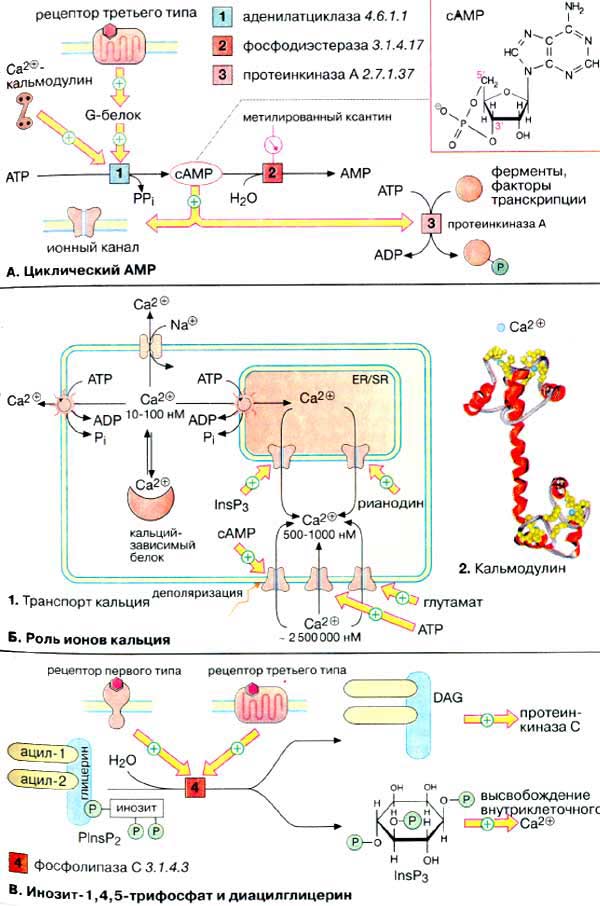
А. Циклический АМФ
Биосинтез. Нуклеотид цАМФ (3',5'-циклоаденозинмонофосфат, сАМР} синтезируется мембранными аденилатциклазами [1] — семейством ферментов, катализирующих реакцию циклизации АТФ (АТР) с образованием цАМФ и неорганического пирофосфата. Расщепление цАМФ с образованием АМФ (AMP) катализируется фосфодиэстеразами [2], которые ингибируются при высоких концентрациях метилированных производных ксантина, например кофеином.
Активность аденилатциклазы контролируется G-белками, которые в свою очередь сопряжены с рецепторами третьего типа, управляемыми внешними сигналами. Большинство G-белков (Gs-белки) активируют аденилатциклазу, некоторые G-белки ее ингибируют (Gi-белки). Некоторые аденилатциклазы активируются комплексом Са2+/кальмодулин.
Механизм действия. цАМФ является аллостерическим эффектором протеинкиназ А (ПК-Α) [3] и ионных каналов. В неактивном состоянии ПК-Α является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и К-единицы активируются. Фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков.
Наряду с цАМФ функции вторичного мессенджера может выполнять и цГМФ (cGMP). Оба соединения различаются по метаболизму и механизму действия.
Уровень ионов кальция. Концентрация ионов Са2+ в цитоплазме нестимулированной клетки очень низка (10-100 нМ). Низкий уровень поддерживается кальциевыми АТФ-азами (кальциевыми насосами) и натрий-кальциевыми обменниками. Резкое повышение концентрации ионов Са2+ в цитоплазме (до 500-1000 нМ) происходит в результате открывания кальциевых каналов плазматической мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического ретикулума). Открывание каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов (глутамат и АТФ, см. с. 342), вторичных мессенджеров (ИФ3 и цАМФ), а также вещества растительного происхождения рианодина. В цитоплазме и клеточных органеллах имеется множество белков способных связывать Са2+, некоторые из них выполняют роль буфера.
При высокой концентрации в цитоплазме ионы Са2+ оказывает на клетку цитотоксическое действие. Поэтому уровень кальция в отдельной клетке испытывает кратковременные всплески, увеличиваясь в 5-10 раз, а стимуляция клетки увеличивает лишь частоту этих флуктуаций.
Действие кальция опосредовано специальными Са2+-связывающими белками («кальциевыми сенсорами»), к которым принадлежат аннексин, кальмодулин и тропонин. Кальмодулин — сравнительно небольшой белок (17 кДа) — присутствует во всех животных клетках. При связывании четырех ионов Са2+ (на схеме голубые кружочки) кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета.
B. Инозит-1,4,5-трифосфат и диацилглицерин
Гидролиз фосфатидилинозит-4,5-дифосфата [ФИФ2 (PlnsP2)] фосфолипазой С [4] приводит к образованию двух вторичных мессенджеров: инозит-1,4,5-трифосфата и диацилглицерина. Гидрофильный ИФ3 поступает в эндоплазматический ретикулум [ЭР (ЕR)] и индуцирует высвобождение ионов Са2+ из запасающих везикул. Липофильный ДАГ остается в мембране и активирует протеинкиназу C, которая в присутствии Са2+ фосфорилирует различные белковые субстраты, модулируя их функциональную активность.


