Опиоидные пептиды
ОПИОИДНЫЕ ПЕПТИДЫ, группа прир. и синтетич. пеп-тидов, сходных с опиатами (морфин, кодеин и др.) по способности связываться с опиагными рецепторами организма (структуры нервной системы, по отношению к к-рым опиаты являются экзогенными лигандами). Природные опиоидные пептиды (эндогенные лиганды опиатных рецепторов) выделены впервые в 1975 из мозга млекопитающих. Это были т. наз. энкефалины - лейцин-энкефалин H2N—Туг—Gly—Gly—Phe—Leu—COOH (мол. м. 556; букв. обозначения см. в ст. Аминокислоты)и метионин-энкефалин H2N—Туr— Gly—Gly—Phe—Met—COOH (мол. м. 574), представляющие собой пентапентиды, различающиеся лишь С-конце-вым аминокислотным остатком. Аминокислотная последовательность метионин-энкефалина идентична фрагменту 61-65 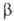 -липотропина.
-липотропина.
Из экстрактов тканей гипофиза и гипоталамуса млекопитающих выделены и другие опиоидные пептиды, получившие групповое название эндорфины. Все они в N-концевой области молекулы содержат обычно остаток энкефалина. Различают 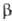 -эндорфин (ф-ла I),
-эндорфин (ф-ла I),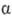 -эндорфин (его молекула тождественна фрагменту 1-16 (3-эндорфина),
-эндорфин (его молекула тождественна фрагменту 1-16 (3-эндорфина), 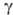 -эндорфин (состоит из остатка
-эндорфин (состоит из остатка 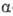 -эндорфина, связанного на С-конце с остатком лейцина) и
-эндорфина, связанного на С-конце с остатком лейцина) и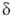 -эндорфин (
-эндорфин (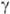 -эндорфин, связанный на С-конце с Phe—Lys).
-эндорфин, связанный на С-конце с Phe—Lys). 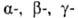 и
и  -Эндорфины тождественны соотв. фрагментам 61-76, 61-91, 61-77 и 61-79
-Эндорфины тождественны соотв. фрагментам 61-76, 61-91, 61-77 и 61-79 -липотропина. К природным опиоидным пептидам относятся также
-липотропина. К природным опиоидным пептидам относятся также  -неоэндорфин (II), (b-нео-эндорфин (отличается от предыдущего отсутствием на С-конце остатка лизина), динорфин А (III), динорфин Б (IV), динорфин-32 (состоит из остатков динорфина А и динор-фина Б, связанных дипептидом Lys—Arg соотв. по С- и N-концам), дерморфин (V), киоторфин (H2N—Туг—Arg—COOH), казоморфин-5 (H2N—Туг -Pro—Phe—Pro—Gly—COOH), казоморфин-7 (отличается от предыдущего наличием на С-конце дополнительно двух аминокислотных остатков Pro—Ilе и нек-рые др. пептиды.
-неоэндорфин (II), (b-нео-эндорфин (отличается от предыдущего отсутствием на С-конце остатка лизина), динорфин А (III), динорфин Б (IV), динорфин-32 (состоит из остатков динорфина А и динор-фина Б, связанных дипептидом Lys—Arg соотв. по С- и N-концам), дерморфин (V), киоторфин (H2N—Туг—Arg—COOH), казоморфин-5 (H2N—Туг -Pro—Phe—Pro—Gly—COOH), казоморфин-7 (отличается от предыдущего наличием на С-конце дополнительно двух аминокислотных остатков Pro—Ilе и нек-рые др. пептиды.
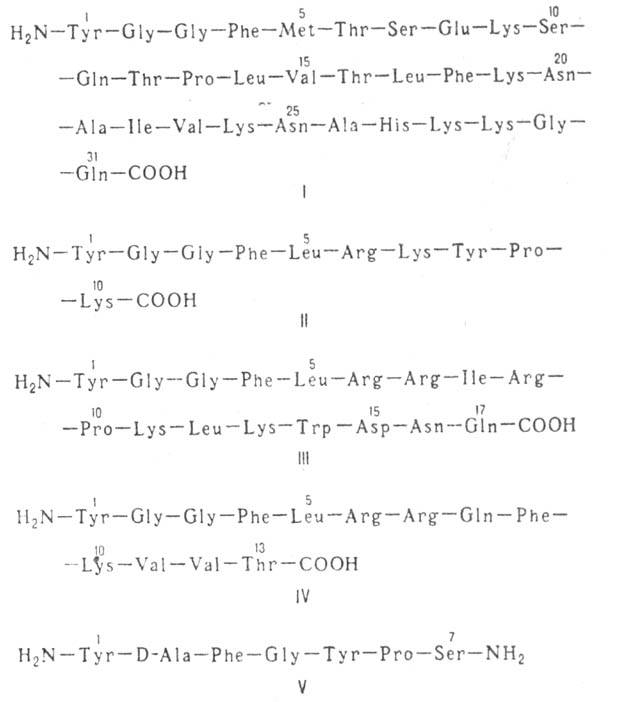
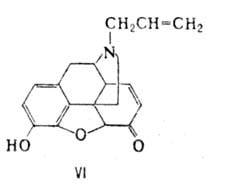
Все эндогенные опиоидные пептиды синтезируются в организме в виде крупных белков-предшественников, из к-рых они освобождаются в результате протеолиза. Известны три разл. белка-предшественника опиоидных пептидов: проэнкефалин, проопиомеланокор-тин и продинорфин. Пространств. строение энкефалинов и морфина сходно. Энкефалины и эндорфины обладают обезболивающим действием (при их введении непосредственно в мозг), снижают двигат. активность желудочно-кишечного тракта, влияют на эмоциональное состояние. Действие опиоидных пептидов исчезает через неск. секунд после введения налоксона (VI)-антагониста морфина.
Одновременно с осуществлением полного хим. синтеза природных опиоидных пептидов интенсивно изучаются их разнообразные синтетич. аналоги. Особое внимание уделяется синтезу аналогов опиоидных пептидов, обладающих повыш. устойчивостью к действию протеолитич. ферментов. Нек-рые синтетич. аналоги опиоидных пептидов проявляют мор-финоподобную активность при периферич. введении.
Лит.: Эндорфины, под ред. Э. Коста, М. Трабукки, пер. с англ., М., 1981; Якубке Х.-Д., Ешкайт X., Аминокислоты, пептиды, белки, пер. с нем., М., 1985, с. 289-95. Ю. П. Швачкин.
