Силаны
СИЛАНЫ (кремневодороды) SinH2n+2, где n = 1 - 8. Силаны-аналоги предельных углеводородов, отличаются от них неустойчивостью цепей —Si—Si—. Высший известный член гомологич. ряда-октасилан Si8H18. Плотности силанов (см. табл.) выше плотностей соответствующих "углеводородов, т-ры кипения и плавления повышаются более резко, чем у углеводородов.
Моносилан SiH4 и дисилан Si2Нб-бесцв. газы с неприятным запахом, остальные силаны-бесцв., легко подвижные, ядовитые, летучие жидкости с еще более неприятным запахом. Силаны пирофорны, дисилан взрывает при контакте с воздухом. Наиб. термически стоек моносилан, энергия связи Si — H 364 кДж/моль, т. разл. 500 °С в отсутствие катализаторов, в стеклянном сосуде он разлагается при 300 °C. Силаны раств. в этаноле, бензине, органосиланах, CS2; при попадании воздуха в сосуд с р-ром силанов в CS2 происходит взрыв.
| ХАРАКТЕРИСТИКА СИЛАНОВ | |||||
| Показатель | SiH4 | Si2H6 | Si3H8 | Si4H10 | |
| Т. пл., °С | -184,67* | -131 | -117,4 | -84,3 | |
| Т. кип., °С | -111,9 | -14,5 | 52,9 | 108 | |
| Плота., г/см3 | 0,68 (-185°С) | 0,686 (-25 °С) | 0,743 (0°С) | 0,825 (0°С) | |
| | 42,79 | 79,0 | - | — | |
| DНисп, кДж/моль | 12,41 | 21,3 | .29,05 | 35,5 | |
| | 34,7 | 95,76 | 91,75** | - | |
| | 204,10 | 274,2 | — | — | |
| * DHпл 0,67 кДж/моль. ** Для газа | |||||
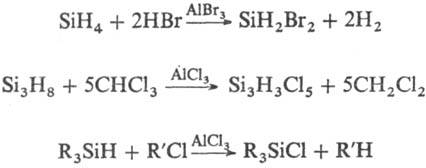
Характерное св-во силанов-их чрезвычайно легкое окисление. Для соед. с п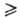 3 р-ция происходит с сильным взрывом. Моносилан в присут. О2 окисляется со вспышкой даже при т'-ре жидкого воздуха. В зависимости от условий р-ции продуктом окисления является либо SiO2, либо промежут. в-ва. Силаны-хорошие восстановители, они переводят КМnО4 в MnO2, Hg(II) в Hg(I), Fe(III) в Fe(II) и т.д. Др. характерное св-во силанов-легкость гидролиза, особенно в щелочной среде, напр.:
3 р-ция происходит с сильным взрывом. Моносилан в присут. О2 окисляется со вспышкой даже при т'-ре жидкого воздуха. В зависимости от условий р-ции продуктом окисления является либо SiO2, либо промежут. в-ва. Силаны-хорошие восстановители, они переводят КМnО4 в MnO2, Hg(II) в Hg(I), Fe(III) в Fe(II) и т.д. Др. характерное св-во силанов-легкость гидролиза, особенно в щелочной среде, напр.:
SiH4 + 2Н2О : SiO2 + 4Н2 SiH4 + 2NaOH + Н2О : Na2 SiO3 + 4Н2
Р-ция протекает количественно и может служить для определения силанов Под действием щелочи возможно также расщепление связи Si — Si, напр.:
H3Si—SiH2—SiH3 + 6H2O : 3SiO2 + 10H2
С галогенами силаны реагируют со взрывом, при низких т-рах образуются галогениды кремния (см. Кремния фториды, Кремния хлориды). С галогеноводородами, ацил- или алкил-галогенидами силаны также образуют галогениды Si (кат.-АlСl3 или АlВr3, т-ра 100-200°С):
С кислородсодержащими соед., напр. с ацетоном, диэти-ловым эфиром, силаны реагируют в газовой фазе при высокой т-ре с образованием алкоксисиланов ROSiH3. С алифатич. спиртами в присут. ионов ОН- (катализатор) силаны образуют тетраэфиры.
Получают силаны след. способами: 1) разложение силицидов металлов к-тами или щелочами. Часто используют Mg2 Si, к-рый разлагают соляной к-той в инертной атмосфере. Вероятная схема р-ции:
Mg2Si + 2Н2 О : Н2Si(MgOH)2
H2Si(MgOH)2 + 4НСl : 2MgCl2 + 2H2O + H2 + (SiH2)2 (SiH2 )2 + H2О : H2SiO + SiH4
Образующиеся силаны разделяют ступенчатой конденсацией, а затем отдельные фракции разгоняют при низкой т-ре.
2) Восстановление галогенидов Si гидридом Li или LiAlH4. В среде этанола при нормальной т-ре идут, напр., след. р-ции:
SiCl4 + LiAlH4 : SiH4 + LiCl + AlCl3 2Si2 Cl6 + 3LiAlH4 : 2Si2 H6 + 3LiСl + 3AlCl3
С LiAlH4 образуются чистые силаны с высоким выходом.
3) Восстановление галогенидов Si водородом. Процесс ведут в присут. галогенидов А1 или же добавляют Аl или Zn как компоненты р-ции. SiH4 получают также разложением (C2H5O)3SiH при 20-80°С в присут. Na. Моносилан-исходное в-во при получении полупроводникового кремния.

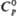 ,Дж/(моль·К)
,Дж/(моль·К)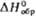 , кДж/моль
, кДж/моль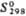 , Дж/(моль·К)
, Дж/(моль·К)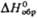 120,8 кДж/моль.
120,8 кДж/моль.