Триптофанa3а
ТРИПТОФАНA3А (триптофан-индол-лиаза), фермент класса лиаз, катализирующий расщепление триптофана:
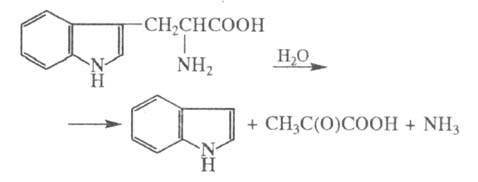
Катализирует также расщепление по такой же схеме др. b-замещенных 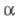 -L-аминокислот [напр., цистеин, серин, CH3SCH2CH(NH2)COOH]; обратную р-цию - синтез триптофана [при избытке NH3 и CH3C(O)COOH]; замещение индо-лильного остатка в триптофане (в т.ч. если в цикле есть заместители) на C6H5S, CH3S, HS и RO при действии соотв. C6H5SH, CH3SH, H2S и ROH; изотопный обмен a-Н-атома на дейтерий у мн.
-L-аминокислот [напр., цистеин, серин, CH3SCH2CH(NH2)COOH]; обратную р-цию - синтез триптофана [при избытке NH3 и CH3C(O)COOH]; замещение индо-лильного остатка в триптофане (в т.ч. если в цикле есть заместители) на C6H5S, CH3S, HS и RO при действии соотв. C6H5SH, CH3SH, H2S и ROH; изотопный обмен a-Н-атома на дейтерий у мн.
Триптофаназа широко распространена среди разл. видов бактерий. Наиб. изучена триптофаназа из штаммов В/1t7-А и К-12 Escherichia coli. Молекула триптофаназы содержит 4 идентичные субъединицы с мол. м. 54 тыс., состоящих из одной полипептидной цепи (ее первичная структура известна). Каждая субъединица в активном центре связывает одну молекулу пиридоксальфосфата (ПЛФ; см. Витамин B6). Активный комплекс триптофаназы с ПЛФ образуется в присут. NH4+, К+ и Rb+ (Na+ ингибирует триптофаназу). Оптим. каталитич. активность триптофаназы при рН 8,0-9,0; рI4,95.
В присуг. ионов K+ и NH+4 триптофаназа имеет 2 характерных рН-за-висимых максимума в спектре поглощения в областях 337 и 420 нм, обусловленных альдиминной группой (основание Шиффа), образованной альдегидной группой ПЛФ с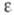 -аминогруппой остатка лизина-270. В связывании ПЛФ принимают также участие остатки цистеина-298 и триптофана-330.
-аминогруппой остатка лизина-270. В связывании ПЛФ принимают также участие остатки цистеина-298 и триптофана-330.
Конкурентные, обратимые ингибиторы триптофаназы- нек-рые аминокислоты, напр. L-аланин.
Лит.: Snell E. E., "Adv. Enzymol.", 1975, v. 42, r. 287-333; Miles E. W., Vitamin B6, pyridoxal phosphate, v. 1, pt B, N. Y., 1986, p. 253-310. И. С. Дементьева.
