Антрацен
АНТРАЦЕН (от греч. anthrax - уголь), мол. м. 178,24; бесцв. кристаллы с голубовато-фиолетовой флуоресценцией, сохраняющейся в р-ре и расплаве; т. пл. 216°С, т. кип. 342°С; возгоняется; d4251,283; С° 209Дж/(г*К); Н°обр -128кДж/моль,
Н°обр -128кДж/моль, Н°ПЛ28,86 кДж/моль,
Н°ПЛ28,86 кДж/моль, Sо298 207,5 Дж/(моль*К); р-римость: в этаноле - 0,076% (16°С) и 0,83% (78 °С); эфире - 1,2% (25 °С); плохо раств. в ацетоне, CS2, хлороформе, СС14, раств. в горячих бензоле и толуоле, не раств. в воде.
Sо298 207,5 Дж/(моль*К); р-римость: в этаноле - 0,076% (16°С) и 0,83% (78 °С); эфире - 1,2% (25 °С); плохо раств. в ацетоне, CS2, хлороформе, СС14, раств. в горячих бензоле и толуоле, не раств. в воде. 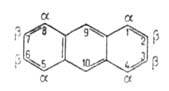
Молекула антрацена - плоская, длины связей (в нм) неравноценны (см. рис.). В УФ-спектре антрацена 310 нм (lg
310 нм (lg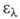 3,3), 324 нм (lg
3,3), 324 нм (lg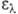 3,6), 340 нм (lg
3,6), 340 нм (lg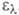 3,7), 356 нм (lg
3,7), 356 нм (lg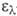 4,0) и 375 нм (lg
4,0) и 375 нм (lg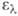 4,0).
4,0).
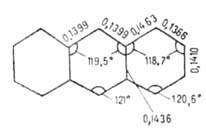
Антрацен - конденсированный ароматич. углеводород; эмпирич. энергия резонанса 3,62 эВ. наиб. реакционноспособны положения 9 и 10 (мезо-положения), присоединение по к-рым не связано с большой потерей энергии резонанса. В положения 9,10 антрацен легко присоединяет диенофилы, в частности малеиновый ангидрид с образованием аддукта ф-лы I, к-рый уже при слабом нагревании регенерирует исходный продукт; р-цию используют для очистки антрацена. Подобно диеновым углеводородам, антрацен присоединяет щелочные металлы, напр. с Na образует 9,10-динатрий-9,10-дигидроантрацен- синее легко окисляющееся в-во. При УФ-освещении р-ров антрацена происходит присоединение О2 с образованием эндопероксида И, разлагающегося при 120°С со взрывом. При фотодимеризации антрацена образуется труднорастворимый диантрацен, распадающийся в темноте на антрацен. Гидрируется антрацен сначала в 9,10-дигидроантрацен; на никелевом кат. происходит исчерпывающее гидрирование. Легко окисляется Н2СrО4, конц. HNO3 и др. в антрахинон. Галогенируется и нитруется с образованием продуктов 9,10-присоединения, к-рые легко превращ. в 9-замещенные (отщепляются молекулы галогеноводорода и элементов азотистой к-ты соотв.). 9,10-Дигалогенантрацены легко обменивают атомы галогенов на гидрокси- и сульфогруппы, образуют магнийорг. соединения и окисляются до антрахинона. 1- и 2-Галогенантрацены не синтезируются непосредственным галогенированием; их получают из соответствующих антрахинонов восстановлением Zn-пылью в NH3. Восстановление разнообразных производных антрахинона широко используется для синтеза замещенных антрацена.
Антрацен легко сульфируется; введенная в одно кольцо сульфогруппа мало влияет на реакц. способность др. колец, поэтому антрацен обладает повыш. способностью к образованию дисульфокислот. При сульфировании антрацена конц. H2SO4 выход сульфокислот невелик из-за образования большого кол-ва 9,9'-биантрила и полимерных продуктов. При сульфировании антрацена в диоксане действием HSO3C1 образуется 9-антраценсульфокислота, легко подвергающаяся десульфированию. В результате в реакц. среде накапливаются 1-и 2-антраценсульфокислоты. При сульфировании антрацена 100%-ной H2SO4 в уксусной к-те образуется 1-антраценсульфокислота (выход 62%).
Антрацен содержится в антраценовом масле (см. Каменноугольная смола), откуда его и выделяют, очищают от примесей (гл. обр. от фенантрена и карбазола), промывают р-рителями и перекристаллизовывают из пиридиновых оснований. Антрацен применяют для получения гл. обр. антрахинона, монокристаллы антрацена - для сцинтилляционных счетчиков.
Для антрацена ниж. КПВ 5 г/м3, т. самовоспл. 946 °С. Пыль пожароопасна. При ее вдыхании наблюдается отек век, раздражение слизистых оболочек, жжение и зуд кожи; ПДК 0,1 мг/м3.
Литература
Клар Э., Полициклические углеводороды, пер. с англ., т. 1, М., 1971; Kirk-Othmer encyclopedia, v. 1, N. Y.-[a.o.J, 1947, p. 941-43; Ullmann's Encyklopadie, 4 Aufl., Bd 7, Weinheim, 1974, S. 577-78. Г.И. Пуца.
