Бутиролактон
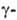 БУТИРОЛАКТОН (бутанолид), мол. м. 86,09; бесцв. гигроскопич. жидкость; т. пл. — 44°С, т. кип. 204°С, 134°С/100 мм рт.ст.; d420 1,129, nD20 1,4362; легко раств. в воде и многих орг. р-рителях, трудно-в алканах и циклоалканах;
БУТИРОЛАКТОН (бутанолид), мол. м. 86,09; бесцв. гигроскопич. жидкость; т. пл. — 44°С, т. кип. 204°С, 134°С/100 мм рт.ст.; d420 1,129, nD20 1,4362; легко раств. в воде и многих орг. р-рителях, трудно-в алканах и циклоалканах;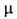 13,62*10-30 Кл*м.
13,62*10-30 Кл*м.
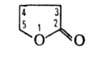
В воде медленно гидролизуется до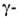 гидроксимасляной к-ты. Скорость гидролиза возрастает при нагр. в кислой среде. С NaOH образует Na-соль
гидроксимасляной к-ты. Скорость гидролиза возрастает при нагр. в кислой среде. С NaOH образует Na-соль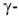 гидроксимасляной к-ты. При взаимод. с нуклеофилами разрывается связь между О и С в положении 5:
гидроксимасляной к-ты. При взаимод. с нуклеофилами разрывается связь между О и С в положении 5: 
где Х = С1, Br, CN, RS, AlkO, RSO2.
Для бутиролактона характерны р-ции по активированной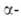 метиленовой группе (в положении 3)-хлорирование, бромирование, конденсация с бензальдегидом и др. С ароматич. углеводородами в присут. к-т Льюиса бутиролактон реагирует в зависимости от условий р-ции с образованием производных
метиленовой группе (в положении 3)-хлорирование, бромирование, конденсация с бензальдегидом и др. С ароматич. углеводородами в присут. к-т Льюиса бутиролактон реагирует в зависимости от условий р-ции с образованием производных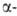 тетралона или фенилмасляной к-ты. Амины, NH3, гидразины и NH2OH раскрывают цикл бутиролактона с образованием амидов, гидразидов и гидроксамовых к-т. При взаимод. бутиролактона с СО в присут. никелевых или кобальтовых кат. образуется с высоким выходом глутаровая к-та. Алкоголят Na катализирует конденсацию двух молекул бутиролактона по положению 3 с образованием
тетралона или фенилмасляной к-ты. Амины, NH3, гидразины и NH2OH раскрывают цикл бутиролактона с образованием амидов, гидразидов и гидроксамовых к-т. При взаимод. бутиролактона с СО в присут. никелевых или кобальтовых кат. образуется с высоким выходом глутаровая к-та. Алкоголят Na катализирует конденсацию двух молекул бутиролактона по положению 3 с образованием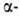 дибутиролактона. При действии разл. окислителей бутиролактон превращ. в янтарную кислоту, при сплавлении с Na2S или NaOH образуются Х(СН2СН2СН2СООН), где X - соотв. S или О.
дибутиролактона. При действии разл. окислителей бутиролактон превращ. в янтарную кислоту, при сплавлении с Na2S или NaOH образуются Х(СН2СН2СН2СООН), где X - соотв. S или О.
Бутиролактон получают в пром-сти дегидрированием 1,4-бутиленгликоля в жидкой (кат. - Сu/SiO2; 200°С) или паровой (кат. - Cu/пемза; 230-250 °С) фазах или гидрированием малеинового ангидрида. Применяют в произ-ве 2-пирролидонов (взаимод. бутиролактона с NH3), в качестве р-рителя для пестицидов и полимеров (напр., полиакрилонитрила, эфиров целлюлозы).
Литература
Methoden der organischen Chemie (Houben- Weyl), 4 Aufl., Bd VI/2, Tl 2, Stuttg., 1963, S. 561-852. В. А. Шведов.
