§ 5. Окислительно–восстановительные реакции
Все процессы неорганической химии можно разбить на два типа: а) идущие без изменения валентности реагирующих элементов и б) идущие с изменением валентности. К первому из них относятся различные случаи обменного разложения, уравнения которых обычно весьма просты. Ко второму типу относятся реакции вытеснения и ряд иных, часто очень сложных химических процессов. Для быстрого и правильного составления их уравнений необходимо овладеть специально разработанной методикой.
Реакции второго типа называются окислительно–восстановительными или, сокращенно (но не вполне точно), реакциями окисления. Первоначально под окислением понималось только присоединение к веществу кислорода, под восстановлением – его отнятие. Понятия «окисление» и «восстановление» можно, однако, обобщить, если принять во внимание, что кислород почти всегда оттягивает к себе электроны от соединяющегося с ним элемента. Вследствие этого сущность окисления состоит в потере электронов окисляющимся веществом. Наоборот, при восстановлении оно получает обратно отданные ранее электроны., Следовательно, сущность восстановления состоит в присоединении электронов восстанавливающимся веществом.
Для дальнейших рассуждений несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная связь). Поэтому при разборе материала данного параграфа мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, следовательно, окислительно–восстановительные реакции можно определить как процессы, связанные с переходом электронов от одних атомов к другим.
Рассмотрим ряд соединений хлора:
НСl Сl2 Сl2 О Сl2 О7
В НСl хлор отрицательно одновалентен. В молекуле Сl2 ни один , из атомов не оттягивает электронов больше другого; следовательно, заряд каждого из них равен нулю. В Сl2 О хлор снова одновалентен, но уже положительно. В Cl2 O7 хлор положительно семивалентен. Схематически все это можно обозначить так:
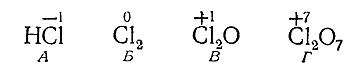
Говоря о переходе хлора из состояния А в состояние Г, можно сказать, что он отдает восемь электронов, при переходе от В к Г – шесть электронов, от Б к Г – семь электронов. Наоборот, при переходе от Г к В каждый хлор присоединяет шесть электронов, от Г к Б – семь электронов, от Г к А – восемь электронов. Вещество, в состав которого входит элемент, присоединяющий электроны, называется окислителем; вещество, содержащее элемент, отдающий электроны– восстановителем.
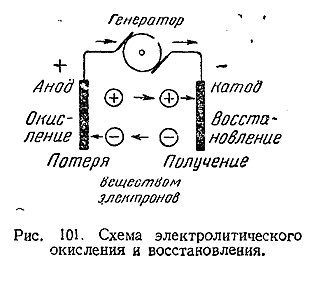
1) Соотношение между понятиями «восстановитель» и «окислитель» может быть наглядно выражено схемой: восстановитель <=> электроны <=> окислитель. Простейшей окислительно–восстановительной системой является установка для электролиза (рис. 101). В ней катод отдает ионам электроны, т. е является восстановителем, а анод их с ионов снимает, т. е. функционирует как окислитель. Следует отметить, что из всех имеющихся в распоряжении химии окислительно–восстановительных методов электролиз является самым мощным и универсальным.
2) При работах с окислителями и восстановителями удобно пользоваться их нормальными концентрациями. Под нормальным раствором окислителя или восстановителя понимают раствор, содержащий в литре один окислительный эквивалент, т. е. часть грамм–молекулы, отвечающую одному присоединяемому или отдаваемому каждой молекулой электрону. Например, при применении в качестве окислителя НСlO3, восстанавливающейся до НСl, валентность хлора изменяется от +5 до –1, т. е. один его атом (а следовательно, и одна молекула НСlO3 ) присоединяет 6 электронов.
Поэтому нормальный раствор НClO3, как окислителя, будет содержать в литре 1/6 грамм–молекулы (а как кислоты – одну грамм–молекулу). Все обозначения концентраций остаются такими же, как и при нормальных растворах кислот и оснований (V § 5).
Для составления уравнения окислительно–восстановительной реакции прежде всего необходимо знать химические формулы вводимых в нее веществ и получающихся продуктов. Первые мы, естественно, знаем, вторые же должны быть установлены либо специальным химическим исследованием, либо прямо на основании известных свойств элементов. Так как, однако, окислительно–восстановительные процессы протекают обычно в водных растворах, непосредственно определить, входит ли вода в реакцию или, наоборот, получается в ее результате, часто бывает невозможно, и это выясняется лишь в процессе составления уравнения.
Простейшим примером окислительно–восстановительного процесса может служить любая реакция вытеснения (V § 8). Ниже рассматривается несколько более сложная реакция взаимодействия раствора хлорноватой кислоты с элементарным фосфором.
Исследование продуктов этой реакции показывает, что в результате взаимодействия образуются Н3РО4 и НСl. Следовательно:
НСlО3 + Р => Н3 РО4 + НСl (I)
Найдя заряды меняющих валентность элементов и надписав их над последними, имеем:
HCl+5O3 + P0 => H3P+5O4 + HCl–1 (II)
Из уравнения (II) видно, что валентность хлора изменилась от + 5 до –1. Следовательно, НСlO3 является окислителями одна ее молекула (точнее, хлор) в процессе реакции присоединяет шесть электронов. С другой стороны, валентность фосфора изменилась от 0 до +5. Следовательно, фосфор является восстановителем и каждый его атом отдает пять электронов. Отмечая это под соответствующими веществами, имеем:
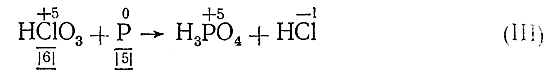
Но все молекулы веществ и уступающих в реакцию и получающихся электронейтральны. Поэтому общее число электронов, отданных в процессе реакции восстановителем, должно быть равно общему числу электронов, присоединенных окислителем. Отсюда находим основные коэффициенты уравнения – коэффициенты при окислителе и восстановителе:
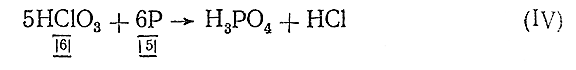
Теперь проверяем число атомов каждого элемента в обеих частях уравнения и расставляем соответствующие коэффициенты (начинать проверку целесообразно с элементов, изменяющих в процессе реакции свою валентность; водород и особенно кислород, если они не входят в уравнение в свободном состоянии, следует обычно проверять последними). Уравняв при помощи коэффициентов число атомов Сl и Р в обеих частях, приходим к следующему выражению:
5НСlО3 + 6Р = 6Н3 РО4 + 5НСl (V)
Проверяя водород, видим, что в правой части уравнения его значительно больше, чем в левой. Так как свободный водород в систему не вводился, это значит, что в реакции участвовала вода. Поэтому окончательно имеем:
5НСlО3 + 6Р + 9Н2 О = 6Н3РО4 + 5НСl (VI)
Проверяя кислород, убеждаемся в том, что уравнение составлено правильно.
Формулируя вкратце разобранное выше, приходим к следующей логической последовательности мысленных операций при составлении уравнений окислительно–восстановительных реакций (попутно в качестве более сложного примера рассмотрено взаимодействие между As2 S3 и HNO3 ):
I. Устанавливаем формулы веществ, получающихся в результате реакции:
As2 S3 + HNO3 = H3 AsO4 + H2 SO4 + NO
II. Определяем валентность элементов, изменяющих ее в процессе реакции, до и после нее:
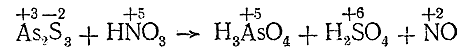
III. Подсчитываем число электронов, отдаваемое молекулой восстановителя и присоединяемое молекулой окислителя:
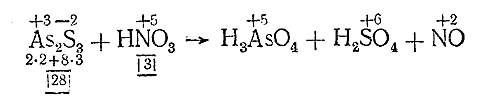
IV. Находим основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
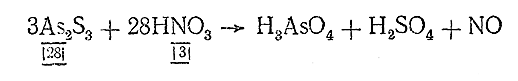
V. Проверяем число атомов каждого элемента (пока без водорода и кислорода) в начальных и конечных продуктах реакции и уравниваем его, расставляя коэффициенты:
3As2 S3 + 28HNO3 = 6H3 AsO4 + 9H2 SO4 + 28NO
VI. Проверяем водород и находим число молекул воды, участвующей в реакции:
3As2 S3 + 28HNO8 + 4Н2 О = 6H8 As04 + 9H2 SO4 + 28NO
VII. Проверяем кислород и убеждаемся в том, что уравнение составлено правильно.
Само собой разумеется, что нет надобности переписывать реакцию несколько раз, и все указанные выше операции производятся последовательно с одним и тем же уравнением (при некотором навыке– в уме). Признаком правильности расставленных коэффициентов является равенство числа атомов каждого элемента в обеих частях уравнения.
Упражнения. Закончить следующие схематические уравнения:
1) Sb2 S5 + HNO3 = H3 Sb04 + H2 SO4 + NO
2) FeSO4 + KClO3 + H2 SO4 = Fe(SO4)3 + KCl
3) HOCl + Br2 = НВrО3 + HCl
4) НСlO3 + HCl = >Cl2
Разобранная выше методика составления уравнений окислительно–восстановительных реакций непосредственно применима к большинству практически встречающихся процессов. Однако в некоторых специальных случаях требуются дополнительные пояснения. Важнейшие из этих случаев рассмотрены ниже.
А) Если число электронов, отдаваемое восстановителем, и число электронов, присоединяемое окислителем, имеют общий наибольший делитель, то оба числа делят на него при нахождении основных коэффициентов. Например, для реакции
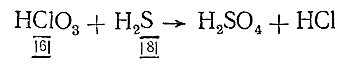
основными коэффициентами будут не 8 и 6, а 4 и 3. Наоборот, если число участвующих в реакции электронов нечетно, а в результате ее должно получиться четное число атомов, основные коэффициенты удваивают. Так, при реакции
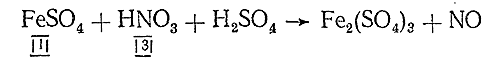
основными коэффициентами будут не 3 и 1, а 6 и 2.
Упражнения. Закончить следующие схематические уравнения:
1) НСlO3 + H2S => H2SO4 + HCl
2) FeSO4 + HNO3 + H2 SO4 => Fe2 (SO4 )3 + NO
3) HClO4 +SO2 => H2 SO4 + HCl
4) FeCl3 + HJ => J2 + FeCl2 + НСl
Б) Окислитель или восстановитель расходуется также на связывание получающихся продуктов.
Например, рассуждая –по–предыдущему, находим, что при реакции (по стадиям I–IV уже проведенной)
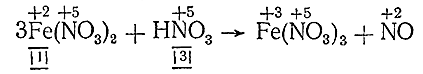
на каждые 3 молекулы восстановителя – Fe(NO3 )2 – нужно затратить одну молекулу окислителя – HNO3 . Однако из сопоставления веществ левой и правой частей уравнения видно, чта, кроме того, при переходе Fe(NO3 )2 в Fe(NO3 )3 на каждую молекулу восстановителя требуется затратить одну молекулу НNОз для дополнительного связывания трехвалентного железа. Таким образом, в общем потребуется азотной кислоты: 1 молекула на окисление плюс 3 молекулы на связывание, т. е. всего 4 молекулы. Уравнение принимает вид
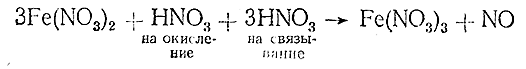
и окончательно (после проведения стадий V и VI):
3Fe(NO3 )2 + 4HNO3 = 3Fe(NO3 )3 + NO + 2Н2 О
Подобный же пример для восстановителя имеем при реакции:
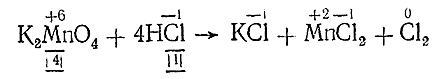
Здесь также находим, что, кроме 4 молекул НСl, реагирующих как восстановитель, необходимо иметь еще 4 ее молекулы для связывания 2К+ и Мn2+. Таким образом, уравнение принимает вид
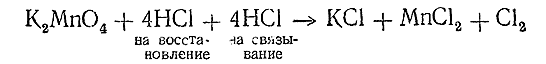
и окончательно:
К2 МnO4 + 8НСl = 2КСl + МnСl3 + 2Cl + 4Н2 O
Упражнения. Закончить следующие схематические уравнения:
1) СrО3 + НСl = > СrСl3 + Сl2
2) Cu2 O + HNO3 = >Cu(NO3 )2 + NO
3) Ag + HNO3 = >AgNO3 +NO
В) Оба элемента – и отдающий и присоединяющий электроны–находятся в одной и той же молекуле. Сюда относятся, в частности, случаи распада вещества на соединения одного и того же элемента одновременно более высокой и более низкой валентностей. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево.
Упражнения, Закончить следующие схематические уравнения:
1) CuJ2 = > CuJ + J2
2) HNO2 = >HNO3 + NO
3) HClO3 = >ClO2 +HClO4
Г) Окислителем (или восстановителем) является перекисное соединение. Так как такие соединения представляют собой производные перекиси водорода, они ведут себя аналогично последней (IV § 5). Сама H2 О2 при окислительном распаде освобождает один атом кислорода, следовательно, молекула ее в качестве окислителя способна присоединить два электрона. При восстановительном распаде Н2 О2 он освобождает два атома водорода, что соответствует возможности отдачи опять–таки двух электронов,
Упражнения. Закончить следующие схематические уравнения:
1) Cr2 (SO4 )3 + Н2 О2 + КОН = > К2 Сr04 +K2 SO4
2) НОСl + Н2 О2 = > НСl + О2
3) Так как связь между одинаковыми атомами неполярна, при подсчете электрохимической валентности она не учитывается. Например, в перекиси водорода Н–О–О–Н кислород, будучи по существу двухвалентным, имеет отрицательную валентность –I.
4) Несовпадение электрохимической и общей валентности может встречаться и в ряде других случаев. Например, приписывая в Н–CN водороду валентность + 1, а азоту –3, получаем для углерода (в силу электронейтральности молекулы) электрохимическую валентность +2.
Следует отметить, что на значениях коэффициентов окислительно–восстановительного уравнения характер внутримолекулярного распределения зарядов не сказывается. Так, для реакции сгорания HCN в кислороде
4HCN + 5O2 = 2H2 O+4CO2 +2N2
основные коэффициенты 4 и 5 вычисляются независимо от того, принять ли для отдельных атомов молекулы HCN приведенные выше электрохимические валентности или какие–либо другие (например, нулевые). Само собой разумеется, что при любом распределении зарядов должна быть обеспечена электронейтральность молекулы в целом.
5) Ввиду малой полярности связей в органических соединениях часто трудно решить, какие из атомов в молекуле поляризованы положительно и какие отрицательно. Поэтому при составлении уравнений реакций окисления органических соединений основные коэффициенты иногда удобнее находить не по непосредственному подсчету числа электронов, а определяя предварительно число атомов кислорода, необходимое для перевода исходной молекулы в продукты реакции. Зная затем, что каждый пошедший на окисление атом кислорода соответствует переходу двух электронов, легко найти и основные коэффициенты уравнения.
Пример. Действием КМnО4 в кислой среде глюкоза может быть нацело окислена по схеме:
C6 H12 O6 = > 6CO2 + 6H2 O
Подсчитывая число атомов кислорода в глюкозе и продуктах ее окисления, находим, что на каждую молекулу глюкозы нужно затратить 12 атомов кислорода. Это соответствует отдаче 24 электронов, в связи с чем и находят основные коэффициенты уравнения:
5С6 Н12 О6+ 24КМnО4 + 36H2 SO4 = 12K2 SO4 + 24MnSO4 + 30СО2 + 66Н2 О
В заключение следует кратко остановиться на зависимости окислительно–восстановительных процессов от реакции среды, в которой они протекают. Чаще всего тот или иной окислитель или восстановитель является таковым только в определенной среде (кислой или щелочной). Сам процесс протекает более или менее энергично в зависимости от степени ее кислотности (щелочности). Иногда влияние характера среды может быть столь значительным, что обусловливает изменение самого направления процесса. Например, взаимодействие по схеме
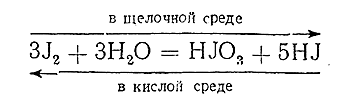
в щелочной среде идет направо, в кислой – налево.
Практически для создания в растворе кислой среды чаще всего пользуются серной кислотой (НСl и HNO3 применяют реже, так как первая из них способна окисляться, а вторая сама является окислителем, и поэтому в обоих случаях иногда могут протекать различные побочные реакции). Для создания щелочной среды служит обычно NaOH или КОН.
Вещество, при помощи которого создается определенная среда, не всегда входит в окончательное уравнение реакции. Рассмотрим, например, следующие случаи окисления посредством КМnО4 в щелочной среде:
I SO2 + KMnO4 + КОН = > K2 SO4 + МnО2
II S + КМnО4 + КОН = > K2 SO4 + MnO2
III H2 S + KMnO4 + КОН = > K2 SO4 + MnO2
После нахождения основных коэффициентов и уравнивания числа атомов, меняющих валентность в процессе реакции, имеем:
3SO2 + 2KMnO4 + КОН = > 3K2 SO4 + 2МnО2
S + 2КМnО4 + КОН = > K2 SO4 + 2МnОа
3H2 S + 8КМnО4 + КОН = > 3K2 SO4 + 8МnО2
Только теперь следует приступать к проверке атомов вещества, создающего определенную среду (пока–без водорода и кислорода). Уравнивание числа атомов калия дает:
3SO2 + 2KMnO4 + 4KOH = >3K2 SO4 + 2MnO2
S + 2KMnO4 = > K2 SO4 + 2MnO2
3H2 S + 8KMnO4 = > 3K2 SO4 + 8MnO2 + 2KOH
Окончательно, после уравнивания водорода и кислорода, получаем:
3SO2 + 2КМnО4 + 4КОН = > 3K2 SO4 + 2МnО2 + 2Н2 О
S + 2KMnO4 = > K2 SO4 + 2MnO2
3H2 S + 8КМnО4 = >3K2 SO4 + 8МnО2 + 2КОН + 2Н2 О
Таким образом, с точки зрения подбора коэффициентов вводимая в систему для создания определенной среды щелочь или кислота ведет себя подобно воде: она может потребляться при реакции (случай I), не участвовать в ней (случай II) или даже дополнительно получаться в ее результате (случай III).


