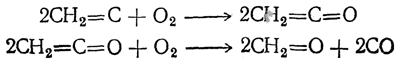Ацетилен C2H2
Ацетилен С2Н2 образуется при нагревании простейших углеводородов — метана, этана и этилена — до высоких температур, а также при сухой перегонке многих органических веществ. Он является постоянной составной частью светильного газа каменноугольного происхождения. Ацетилен был открыт в 1836 г. Дэви; подробному исследованию ацетилен и его соединения подверг Бертело (1860). Исторически очень большое значение имел произведенный Бертело синтез ацетилена из элементов, так как это был первый прямой синтез простейшего углеводорода. Бертело показал, что если создать электрическую дугу между угольными электродами в атмосфере водорода, то последний соединяется с углеродом. При температуре около 2500° С (как оказалось впоследствии, реакция начинается выше 1700° С) образуется 3,7% ацетилена, примерно 1,2% метана и следы этана. До недавнего времени основным источником получения ацетилена являлся производимый в громадных количествах ацетиленид кальция С2Са строения
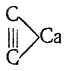
называемый обычно карбидом кальция. Действием на него воды получается ацетилен:
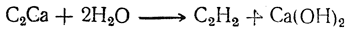
Эта реакция была открыта Вёлером еще в 1862 г., но практически она была использована лишь тридцать лет спустя.
Карбид кальция получается сплавлением негашеной извести с углем в электрической печи:
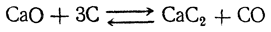
Карбид кальция в чистом виде — белое вещество, совершенно не обладающее взрывчатыми свойствами, которыми отличается большая часть металлических производных ацетилена.
В настоящее время ацетилен получается в промышленности также из парафиновых углеводородов (метана, этана, бутана) или легких нефтяных погонов. Основным условием образования ацетилена из метана является кратковременное, исчисляемое долями секунды пребывание исходного углеводорода в реакционной зоне при высокой температуре (1400—1600°С) и последующее резкое охлаждение газовой смеси. Необходимая для протекания реакции высокая температура может быть создана электрической дугой (в этом случае процесс называется электрокрекингом) или сжиганием части исходного или какого-либо другого углеводорода в кислородном или воздушном пламени (процесс, называемый термоокислительным пиролизом). Во всех случаях в результате реакции образуется сложная газовая смесь, содержащая наряду с ацетиленом непрореагировавшие исходные углеводороды, этилен, водород, высшие ацетиленовые углеводороды, сажу и другие соединения. Чистый ацетилен выделяется обычно из этой смеси в результате серии последовательных операций с помощью селективных растворителей.
Хотя суммарное уравнение этой реакции очень простое

однако механизм ее сложен и до сих пор неполностью выяснен. Несомненно, что она является радикальной цепной реакцией. Вероятнее всего эта цепь развивается так:
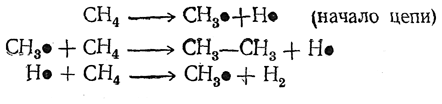
Этан превращается в этилен, а последний дает ацетилен. Не исключено и возникновение радикалов СН•, соединяющихся с образованием ацетилена.
Ацетилен образуется из элементов с большим поглощением тепла (—58 ккал/моль), поэтому при его сжигании выделяется громадное количество тепла (313 ккал/моль). Это является причиной чрезвычайной огнеопасности его смесей с воздухом; к тому же пределы взрываемости этих смесей весьма широки — от 3 до 82% ацетилена, тогда как смеси воздуха со светильным газом взрывают лишь при содержании от 5 до 28% светильного газа. Как соединение эндотермическое ацетилен является веществом взрывчатым, но при атмосферном давлении он не взрывает без детонатора. При повышенном же давлении, и особенно в жидком или твердом состоянии, он взрывает чрезвычайно легко. Сильно взрывчаты многие металлические производные ацетилена, особенно серебряные, ртутные и медные.
Ацетилен обладает наркотическими свойствами.
Смесь ацетилена с воздухом горит ярким пламенем. Когда ацетилен сгорает в смеси с вдуваемым в пламя кислородом, развивается температура, при которой легко могут быть расплавлены многие металлы. Этим пользуются для сварки метал. лов (автогенная сварка). При помощи узкого ацетилено-кислородного пламени можно разрезать стальные балки и другие массивные стальные предметы. В месте прикосновения пламени металл окисляется, а получающиеся окислы плавятся. Требуемый для автогенной сварки ацетилен получают из карбида на месте применения или доставляют в стальных баллонах, где он содержится растворенным в ацетоне под давлением 12—15 ат. Баллон заполняют пористой массой, адсорбирующей раствор ацетилена; в этих условиях ацетон растворяет около 300 объемов ацетилена. Попытки хранить в баллонах жидкий ацетилен были оставлены вследствие ряда происшедших взрывов.
Кислород окисляет ацетилен при 300° С с образованием формальдегида и окиси углерода; вероятно, промежуточно образуется кетен: