Замещения реакции
Замещения реакции, химические превращения, характеризующиеся тем, что «атакующая», частица вытесняет какой-либо атом или группу атомов из др. реагента:
Х + Y - S ® X - S + Y.
В зависимости от характера Х замещения реакции подразделяют на нуклеофильные (sn реакции; Х — анион или молекула, несущая неподелённую электронную пару), электрофильные (se реакции; Х — катион или иная частица, обладающая сродством к электронной паре) и радикальные (sr реакции; Х — частица с неспаренным электроном). Различают мономолекулярные и бимолекулярные замещения реакции. По механизму нуклеофильного мономолекулярного замещения (SN1) протекает, например, гидролиз трет-бутилхлорида, при этом на первой стадии происходит медленная диссоциация на ион карбония и хлорид-ион, на второй — быстрая реакция карбониевого иона с водой с образованием трет-бутилового спирта:
(CH3)3C—Cl ® (CH3)3C+ + Cl-,
(CH3)3C+ + H2O ® (CH3)3C—OH + H+.
Для первичных и вторичных алкилгалогенидов более характерен одностадийный гидролиз, при котором разрыв связи С — галоген и образование связи С—ОН происходит синхронно (нуклеофильное бимолекулярное замещение, SN2):
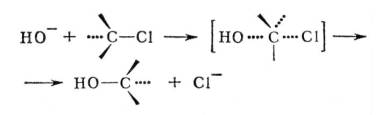
Кинетика процесса в первом случае отвечает первому, во втором — второму порядку (см. Кинетика химическая). Электрофильное замещение наиболее характерно для ароматических соединений, например:
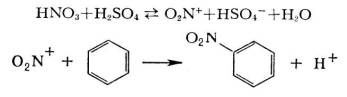
Пример радикального замещения — металепсия (радикально-цепное хлорирование парафинов):
Cl2 ® Cl· + Cl·; Cl· + CH4 ® CH3· + HCl;
CH3· + Cl2 ® CH3Cl и т.д.
Частным видом замещения реакций являются реакции двойного обмена:
X—Y + Z—W ® X—W + Y—Z
и вытеснения:
Zn + CuSO4 ® ZnSO4 + Cu.
Б. Л. Дяткин.
